Selenoproteïna M
THE SEP15 PROTEIN FAMILY
Les Selenoproteïnes SelM i Sep15 són proteïnes de 15 kDa que comparteixen un 31% d’identitat de seqüència i que es localitzen al RE [Labunskyy VM et al.,]. Juntes constitueixen una família de selenoproteïnes que podem distingir de la resta. Sel M i Sep15 contenen els motius Cys-X-X-Sec i Cys-X-Sec respectivament en la seva seqüència, i estudis estructurals basats en ressonància magnètica nuclear (RMN) han revelat que ambdues selenoproteïnes compten amb un plegament constituït per una làmina β central rodejada per α-hèlixs, característic de les tiorredoxines [Ferguson AD et al.,].
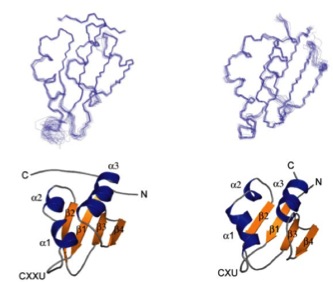
Figura 1: Imatges obtingudes amb RMN de les selenoproteïnes SelM i Sep15. La localització dels dominis amb activitat redox per a SelM (CXXU) i Sep15 (CXU) estan indicats a la imatge entre el domini C-terminal de la làmina β1 i el domini N-terminal de l’hèlix α1.
La presència d’un plegament del tipus tiorredoxina juntament amb canvis conformacionals que esdevenen després de l’intercanvi tiol-sulfit, a més de l’homologia de seqüència envers les disulfit isomerases [Ferguson AD et al.,], suggereix que ambdues selenoproteïnes actuen com a tiol-disulfit oxidoreductases. Sep15 es va demostrar que s’associava amb UGTR (UDP-glucose:glycoprotein glucosyltransferase) al RE, essent aquesta associació la responsable del manteniment d’aquesta selenoproteïna al RE [Korotkov KV et al,.]. D’aquesta manera, sabent que UGTR està involucrat en el control de qualitat del plegament proteic, ambdues proteïnes, Sep15 i Sel M, s’ha suggerit que juguen un paper important en el plegament proteic al RE [Labunskyy VM et al.,], encara que manca una evidència directa in vivo d’aquest paper.
La relació de Sep15 amb el càncer ha sigut reportada a multitud d’estudis in vitro [Apostolou S et al.,]. No obstant això, altres estudis que han treballat amb patrons d’expressió de Sep15 han sigut inconsistents en proveir evidència sobre el rol d’aquesta selenoproteïna en limitar el creixement del càncer [Kumaraswamy E et al.,].
Per altra banda, també trobem que Sep15 i SelM estan altament conservades i es troben presents en gran varietat d’organismes des d’algues verdes fins a humans. En els mamífers, aquestes selenoproteïnes tenen diferents patrons d’expressió tissular. Així, trobem que els niells més elevats de Sep15 s’han observat a la pròstata, al fetge, al ronyó i als testicles; mentre que SelM s’expressa predominantment al cervell. A més a més, els nivells proteics de Sep15 estan majoritàriament regulats pel Seleni de la dieta, encara que en determinats òrgans aquesta dependència és menor, com és el cas dels testicles. Pel que fa a la SelM, aquesta selenoproteïna també està regulada pels nivells de Seleni de la dieta, encara que els detalls d’aquesta regulació, al contrari que Sep15, no són coneguts.
En relació a la seva localització al RE, Sep15 i SelM contenen una senyal peptídica al l’extrem N-terminal que permet aquesta localització específica. No obstant, mentre que SelM està retinguda al RE per un tetrapèptid H/R/K-X-DL a l’extrem C-terminal, Sep15 manca d’una senyal típica de retenció al RE cosa que suggereix que és mantinguda en aquest compartiment cel·lular per un mecanisme de retenció diferent [Labunskyy VM et al.,].
En els últims anys, un nou membre de la família proteica Sep15 va ésser identificat [Novoselov SV et al.,]. Aquesta selenoproteïna es localitzà únicament en peixos i es va denominar Fep15 (fish Sep15-like protein). Fep15 també es localitza al RE gràcies al pèptid senyal N-terminal i té una senyal de retenció al RE en l’extrem C-terminal (RDEL).
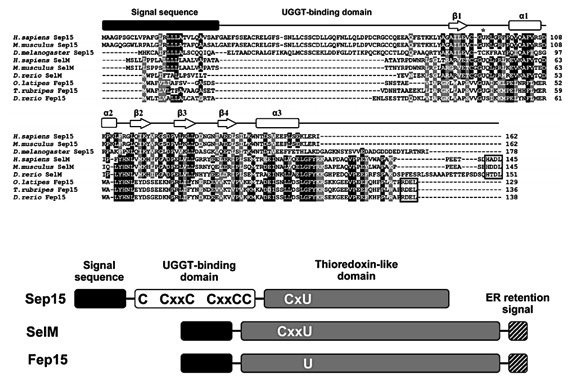
Malgrat que Sep15, SelM i Fep15 comparteixen regions d’identitat de seqüència, tenen importants elements distintius que especificarien diferencies en quant a la seva especificitat de substrat i/o les seves funcions fisiològiques.
Múltiples alineaments de seqüència dels membres de la família Sep15 han revelat que SelM i Fep15 tenen un domini C-terminal elongat, mentre que Sep15 posseeix un domini N-terminal ric en Cisteïna (UGGT-binding domain). Al contrari que SelM, en que el lloc actiu, Cisteïna i Selenocisteïna estan organitzats en motius CxxU altament conservats, Sep15 posseeix un motiu inusual en què Cisteïna i Selenocisteïna estan separades per un únic aminoàcid (CxU). Encara més, Fep15 codifica per un únic residu de Selenocisteïna (U) i té Valina enlloc de la Cisteïna conservada. A més, val a dir que Fep15 no té cap Cisteïna conservada i que en algunes d’elles no n’hi ha cap en tota la seqüència [Labunskyy VM et al.,].
Figura 2.