Selenoproteïnes
El Seleni

El seleni és un element traça de nombre atòmic 34, que tot i ser poc comú a La Terra es considera essencial per al desenvolupament de determinades funcions fisiològiques dels organismes. Com a micronutrient de la dieta el seleni s’associa als processos d’oxidació i reducció degut a la seva alta reactivitat i s’agrupa dins dels micronutrients antioxidants.
Tot i que la seva funció concreta i els processos exactes en que intervé encara no s’han definit amb exactitud es coneixen i s’han descrit els efectes que provoca sobre l’organisme tant el dèficit com l’excés d’aquest element.
El dèficit de seleni provoca una patologia denominada Malaltia de Keshan que cursa amb una debilitació del miocardi provocada per la necrosi de les cèl·lules musculars, derivant en una sèrie de cardiopaties greus. Estudis epidemiològics han demostrat que l’aportació de suplements de seleni contribueix a reduir considerablement la incidència d’aquesta malaltia. Aquests suplements també s’han demostrat eficaços en la prevenció de determinades malalties neurodegeneratives, el càncer de pròstata i reduint l’expressió viral en el curs d’algunes infeccions.
Per altra banda, l’excés de seleni pot conduir a una intoxicació greu denominada selenosi. Aquest síndrome es deriva del fet que el nostre organisme no és capaç de metabolitzar quantitats elevades d’aquest element que s’acumularà en extremitats i articulacions. Per evitar aquest problema, els éssers humans hem evolucionat per fer-lo essencial i evitar-ne així l’excés.
El seleni es pot trobar en forma inorgànica o orgànica però la seva presentació majoritàriaés com a element essencial de les Selenoproteïnes.
Selenoproteïnes
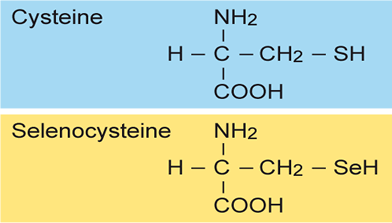
Les selenoproteïnes són un tipus de proteïnes que incorporen a la seva estructura un aminoàcid atípic denominat selenocisteïna. La selenocisteïna és un aminoàcid atípic estructuralment molt semblant a la cisteïna però amb un àtom de seleni ocupant la posició de l’àtom de sofre d’aquesta última. Tot i compartir importants similituds en quant a les seves propietats químiques i físiques, el seleni presenta una reactivitat més elevada que al del sofre fet que confereix a la selenocisteïna importants capacitats oxido-reductores.
La selenocisteïna es troba en qualsevol forma de vida i les selenoproteïnes s’han identificat ja en els tres grans dominis de la vida: eucariotes, procariotes i arquees. En el cas concret dels éssers humans s’han pogut identificar 25 selenoproteïnes. És per això que la identificació d’aquestes proteïnes en nous genomes seqüenciats pot aportar valuosa informació sobre les seves funcions i la seva importància evolutiva. També té rellevància establir relacions d’ortologia entre les diferents espècies en quan a les seves famílies de selenoproteïnes per tal de predir com han evolucionat.
Com hem dit, les selenoproteïnessón generalment enzims que participen en les reaccions d’oxidació i reducció que tenen lloc a l’organisme i recentment s’ha descrit que són essencials per a la supervivència dels metazous.
Síntesi de Selenoproteïnes
Existeix la possibilitat de que algunes selenoproteïnes canviïn el residu de selenocisteïna per una cisteïna comú. En la majoria d’aquests casos perden la funció biològica de la selenoproteïna i no podran ser considerada com a tal.
En primer lloc, com que la selenocisteïna no es troba de forma lliure a la cèl·lula cal una maquinària específica per tal d’incorporar el seleni obtingut de la dieta a la seril-tRNAsec transformant-lo prèviament en monoselenofosfat. Aquest procés està mediat per les proteïnes selenofosfat sintases SPS1 i SPS2.
En procariotes, existeix una única SPS codificada per SelD que requereix ATP i seleni per a desenvolupar la seva funció. Per contra, en eucariotes trobem dos homòlegs a aquesta proteïna que anomenem SPS1 i SPS2.
A continuació, una fosfoseril-tRNAseckinasa (PTSK) s’encarrega de fosforilar la serina unida al tRNA. Aquesta reaccióestà catalitzada per ATP i magnesi.
Finalment SLA/LP o eucaryotic selenocystein syntase ésl’encarregada de transformar la serina unida al tRNA en selenocisteïna.
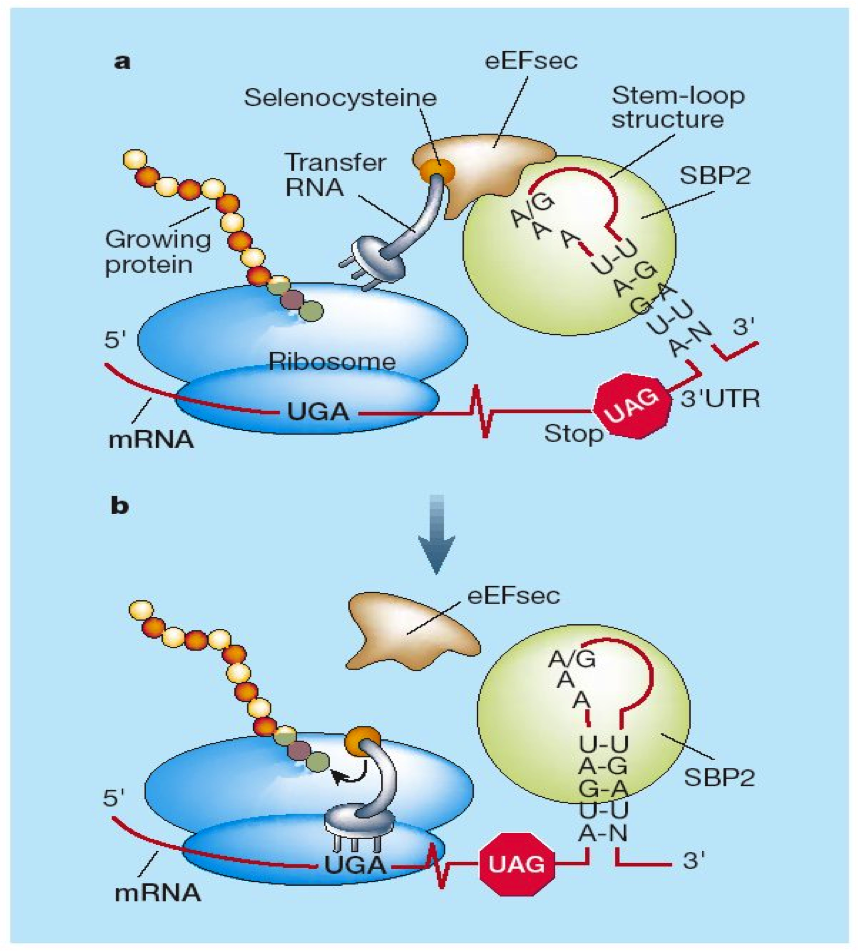
El codó UGA codifica per la selenocisteïna però també és un codó de finalització que un de cada 5000 vegades que apareix en un mRNA. Per tal de distingir quan cal que el codó UGA doni lloc a una selenocisteïna i quan a un codó STOP existeix una estructura denominada SeCIS situada a l’extrem 3’UTR del mRNA. L’estructura SeCIS o Seleno cysteine insertion sequence presenta una conformació tridimencional de 60 nucleótids dels quals els 4 que formen el core estan conservats. A més a més, formen una estructura en forma de loop que en eucariotes i arquees es troba a l’extrem 3’UTR però que en procariotes es troba downstream del codó UGA.
La seqüència SeCIS és capaç d’unir específicament una proteïna anomenada SBP2 o SeCIS binding protein 2. Aquesta proteïna reclutarà un factor d’elongació específic denominat EfSec que es troba unit al tRNA de l’aminoàcid selenocisteïna. Quan es produeix aquest procés la cadena d’aminoàcids incorporarà un aminoàcid selenocisteïna i la traducció continuarà.
Per tant, per a codificar selenocisteïnes cal:
-
-EfSec: és un factor d’elongació específic de selenocisteïna que tot i diferir entre eucariotes i procariotes és sempre una RNA bindingprotein depenent de GTP. En el cas dels protists estudiats el EfSec s’uneix al tRNA a través d’un domini N-terminal i a la proteïna SBP2 per la regió C-terminal.
-SBP2: és una proteïna que un cop unida a la seqüència SeCIS serà capaç de reclutar el ribosoma i tota la maquinària de transcripcióespecífica de selenocisteïna. Com que la seva activitat està subjecte a l’estat redox de la cèl·lula, la síntesi es pot veure afectada en cas d’estrès oxidatiu.
-tRNAsec: tRNA específic per a l’aminoàcid selenocisteïna.
Així doncs, per identificar un gen que conté una selenoproteïna cal que presenti la estructura SeCIS i trobar un codó, normalment STOP, al mig de la seva seqüència.