Selenoproteïnes
Sel15, SelL, Fep15
Adell A, Agustín JM, Andrés C, Bartrolí M, Brasó M
Introducció
El seleni va ser descobert l’any 1817 pel químic suec Jöns Jacob Berzelius. És un oligoelement que va ser ràpidament reconegut com un element essencial tant en organismes procariotes com en eucariotes, i la importància de la seva deficiència com a causa d’algunes malalties, com per exemple la malaltia de Keshan. El seleni té un paper molt important com a antioxidant i, diversos estudis han demostrat que participa en el sistema immunitari i que pot prevenir de l’aparició de determinats càncers.[1]
Torna a dalt
2. Les Selenoproteïnes:La importància del seleni en els organismes es deu a les selenoproteïnes, un conjunt de proteïnes que posseeixen l’aminoàcid número 21, la selenocisteïna (Sec); un anàleg de la cisteïna que conté seleni enlloc de sofre. Apareixen de manera molt àmplia al llarg de l’evolució i les podem trobar en els tres dominis de la vida: eucariota, bacterià i archaea.
Les selenocisteïnes tenen propietats químiques molt similars a les cisteïnes, però a la vegada tenen certes diferències que els hi confereixen més reactivitat.[6]
Torna a dalt
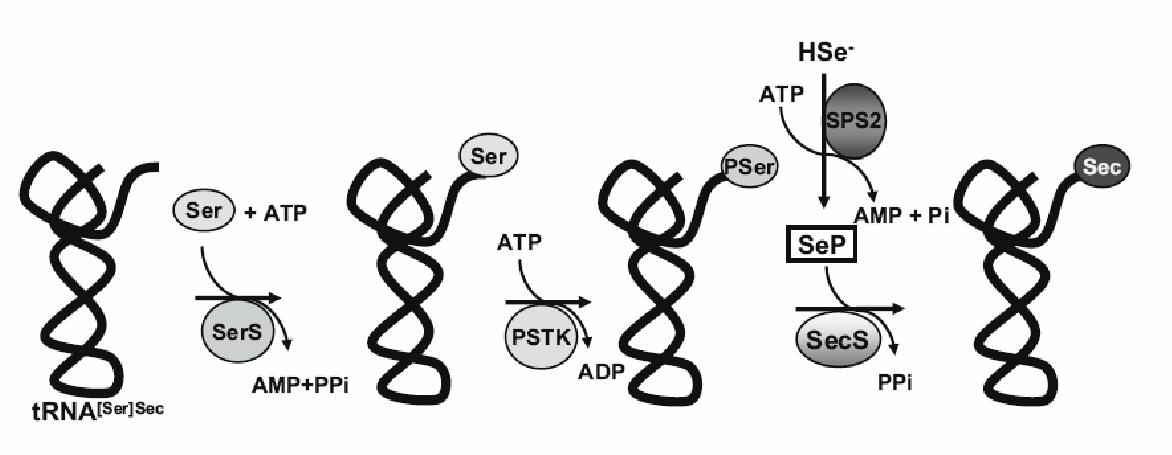
3. Síntesi de les selenocisteïnesLa síntesi de les Sec ocorre exclusivament sobre el seu ARNt ja que no existeix la síntesi de l’aminoàcid lliure. El ARNtSec és prèviament aminoacilat amb serina per una seril-ARNt sintetasa (SerS) donant lloc a seril-ARNtSec, el qual després serà fosforilat per la O-fosfoseril ARNtSec quinasa (PSTK) formant la O-fosfoseril ARNtSec, que per la selenocisteïna sintetasa (SECS) es converteix a selecinocisteinil-ARNtSec. A la vegada, SecS també té com a substrat el selenofosfat (SeP), la síntesi del qual és catalitzada a partir de la selenofosfat sintetasa (coneguda com seID en bacteris i SPS2 en eucariotes).[2]
Torna a dalt
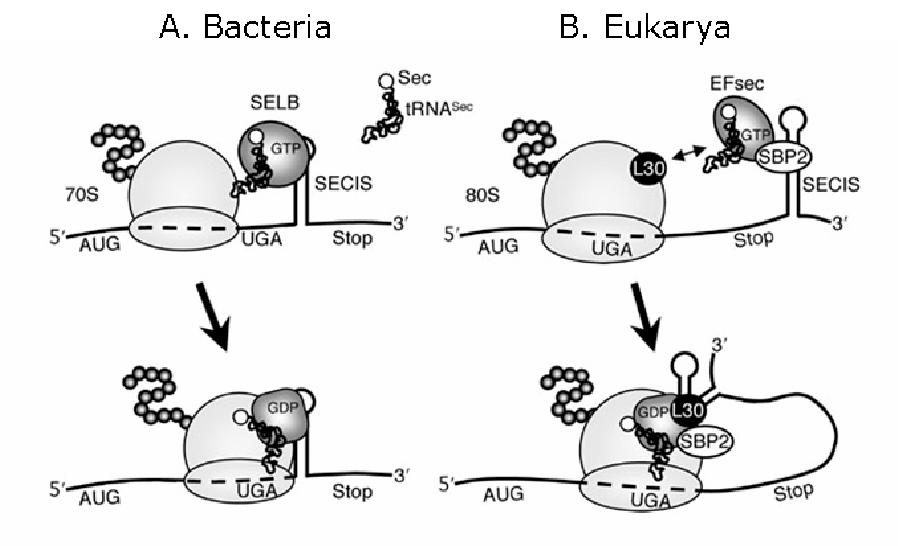
4. Biosíntesi de les selenoproteïnes:Les selenoproteïnes són difícils d’identificar a la seqüència del genoma perquè són codificades pel codó UGA, normalment codó de finalització. La inserció d’una Sec a la síntesi proteica es dóna a partir d’un element anomenat Selenocystein Insertion Sequence (SECIS), necessari per a la recodificació del codó UGA. L’element SECIS és una estructura tridimensional en forma de loop que es localitza en l’extrem 3’ no traduït del mRNA de la selenoproteïna (UTR) en eucariotes i en archaeas, i en la posició downstream del codó UGA en bacteris.
En eucariotes, l’element SECIS recluta una proteïna SECIS Binding Protein (SBP2), la qual s’uneix al factor d’elongació de Sec (EFSec) i s’aproxima al tRNA de la selenocisteïna (tRNAsec). A causa de l’associació amb el ribosoma, el SBP2 es desplaça de l’element SECIS per la proteïna ribosomal i el canvi conformacional de l’element SECIS promou la hidròlisi de GTP i l’alliberació del tRNASec al lloc A del ribosoma que s’uneix al codó UGA del mRNA i en determina la seva traducció. En procariotes, en canvi, el factor d’elongació específic per a Sec (SELB) uneix l’element SECIS, GTP i tRNASec formant un complex. Aquesta unió causa un canvi conformacional de l’element SECIS que intervé en la transferència del tRNASec al lloc A del ribosoma, ocupat per un codó UGA. [3]
Torna a dalt
5. Funcions de les Selenoproteïnes:El selenoproteoma de l’ésser humà consta de 25 proteïnes. No es coneixen totes les funcions de totes les selenoproteïnes, però en els últims anys s’ha avançat substancialment en dilucidar les funcions de moltes d’elles. Són importants en el manteniment de la homeòstasi redox (degut a les selenoproteïnes dels sistemes de la tioredoxina i del glutatió), en el metabolisme de les hormones tirodees i en la funció muscular, entre altres processos fisiològics.[1]
Torna a dalt