Discussió SPS1 i SPS2
Els tBLASTn corresponents als organismes A.taiwanensis, C.muris, C.parvum i E.siliculosus no mostren hits significatius i, per tant, ja no hem seguit amb el procediment explicat a materials i mètodes en cap de les dues proteïnes. Per tant, amb les eines que disposem no podem determinar que aquestes proteïnes estan o no presents en aquests organismes.
Un cas especial ha estat l'anàlisi de SPS2 en P.tricornutum, el qual mostra una proteïna més curta que la resta d'organismes, en l'alineament múltiple. Ara bé, en veure-ho, vam intentar allargar el seu fastasubseq, obtenint així un resultat inesperat, la proteïna resultant no alineava amb la query com una proteïna homòloga en cisteïna com anteriorment, sinò que aquesta alineava amb un triptòfan (W). Conseqüentment, vam realitzar un BLASTp, el qual ens va mostrar que es tractava d'una altre família de proteïna que conservava el domini PurM-like però no el domini SelD característic de SPS. Per aquest motiu, vam decidir obviar aquest resultat i no mostrar-lo en l'alineament global ja que pensem que es tracta d'una altre proteïna.
Pel què fa a l'alineament múltiple de SPS2 dels organismes C.merolae, C.owczarzaki, H.arabidopsidis, N.gruberi i P.ultimum mostra que són homòlegs en cisteïna, mentre que B.hominis, S.parasitica i T.trahens contenen una selenocisteïna.
D'altra banda, P.pallidum conté una proteïna curta i al fer el BLASTp mostra que té el domini SelD conservat i els primers hits pertanyen a SPS. Per aquest motiu, creiem que es tracta d'una proteïna d'aquesta mateixa família, però amb les eines que disposem no hem estat capaces d'obtenir la seva regió N-terminal i, conseqüentment, no podem saber si es tracta d'una proteïna homòloga en cisteïna o bé d'una selenocisteïna.
Finalment, comentar que C.owczarzaki i N.gruberi mostren una proteïna més curta en la part C-terminal, però com que són proteïnes homòlogues en cisteïna hem decidit conservar-los en l'alineament múltiple.
L'alineament múltiple de SPS2 mostra, en general, scores molt bons i, a més a més, els dominis de la proteïna estan molt conservats en tots els organismes.
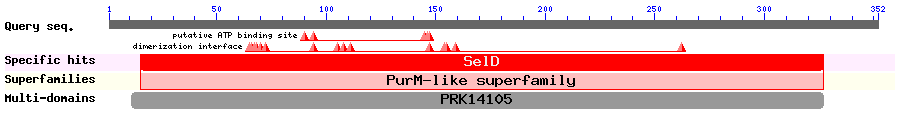
Pel què fa a SPS1 trobem que els organismes C.owczarzaki, C.merolae i P.tricornutum contenen una proteïna homòloga en cisteïna a SPS1. Ara bé, el fet que tant SPS1 com SPS2 hagin sorgit d'una duplicació de SPS procariota, per tant, la query utilitzada per estudiar SPS1 ha perdut la selenocisteïna i l'ha reemplaçat per un altre aminoàcid. Malgrat que el primer domini, on es trobava inicialment la selnocisteïna, no està conservat, veiem que la resta de dominis obtinguts d'aquesta proteïna estan altament conservats, obtenint scores molt alts.
En alguns organismes, la proteïna que hem obtingut ha estat massa curta. Per tant, amb les proteïnes obtingudes hem fet un BLASTp, obtenint així que les proteïnes d'aquests organismes tenen el domini SelD conservat i, que els primers hits pertanyen a proteïnes de la família SPS.
Un cas particular va ser el BLASTp de l'organisme P.pallidum, el qual anotava una única proteïna de la família SPS, però no especificava si es tractava de SPS1 o bé SPS2. Aquest fet tan sorprenent ens va portar a analitzar detalladament totes les proteïnes de la família SPS obtingudes per cada organisme. En primer lloc, vam realitzar un alineament múltiple amb SPS1 i SPS2 de tots els organismes, observant així que algunes eren pràcticament idèntiques mentre que d'altres divergien en algunes regions. Tant era així que vam decidir estudiar l'anotació dels exons mostrats per l'exonerate.
Els resultats ens indiquen que els organismes B.hominis, H.arabidopsidis, N.gruberi, P.pallidum, P.tricornutum, P.ultimum, S.parasitica i T.trahens només hem pogut extreure una única proteïna de la família SPS, ja que les coordenades dels exons són quasi iguals o bé, només hem obtingut una proteïna. D'altra banda, C.merolae i C.owczarzaki, segons l'estudi dels exons, presenten contigs prou diferents per a considerar que tenen SPS1 i SPS2. Tot i això, en l'alineament múltiple veiem que són molt semblants fet que ens fa dubtar de l'existència de dues proteïnes.
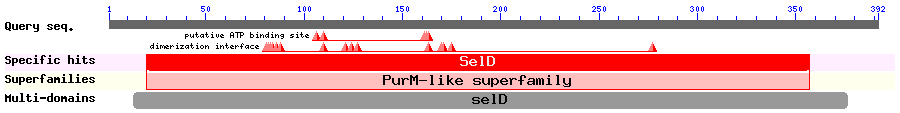
A més a més, l'alineament múltiple de SPS1 i SPS2 mostra que ambdues proteïnes tenen el domini Sel D molt conservat, fet que ens confirma allò que ja sabíem teòricament, és a dir, que ambdós deriven de la proteïna SPS ancestral.
Per a realitzar el jalview hem obviat les proteïnes repetides i anteriorment comentades.
