E.dispar
¿Que son las selenoproteínas?
El Selenio y la Selenocisteína
El selenio se descubrió en 1817, en principio se describió como tóxico, pero finalmente acabó definiéndose como micronutriente esencial, asociado a significantes beneficios para la salud.
La deficiencia de selenio se ha asociado a la enfermedad de Keshan, una cardiomiopatía que afecta a mujeres jóvenes y niños en ciertas regiones de China donde el suelo es pobre en selenio. Esta enfermedad puede prevenirse mediante un suplemento dietético de selenio, como puede hacerse con la enfermedad Kashin-Beck, una osteoartritis deformante también encontrada en China. En humanos, una deficiencia moderada de selenio puede contribuir a la patogeneicidad de infecciones virales, a la progresión del SIDA, a infertilidad masculina y a defectos en la inmunidad.
Este elemento esencial podría tener efectos protectores frente a enfermedades inflamatorias como la artritis, el asma y la ateroesclerosis. Y parece que puede jugar un papel en la reducción del riesgo de varios tipos de cánceres.(1)
En 1970 se descubrió la selenocisteína, el aminoácido número 21. La mayoría de selenio en animales está asociado a proteína, del cual un 80% se encuentra incorporado en forma de selenocisteína a las selenoproteínas.
Estructuralmente la selenocisteína es idéntica a la cisteína, excepto que contiene un átomo de selenio en lugar de azufre. La estructura electrónica del selenio le confiere determinadas características:
- El anión selenolato (la base conjugada) es más estable que el correspondiente tiolato de la cisteína
- el protón selenol es más acídico que el tiol de la cisteína (con un pKa de 5.2 frente al 8.5 del tiol), de aquí la ionización de la selenocisteína a pH fisiológico
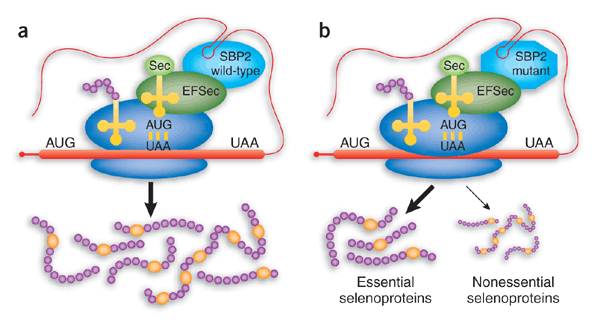
A mitad de los años 80 se descubrió que la selenocisteína está codificada por el codón UGA, normalmente traducido como codón stop o de terminación de la síntesis proteica.
Es por ello que la traducción de mRNA de selenoproteínas requiere tanto secuencias en cis en el tránscrito como factores que se dedican a la incorporación de selenocisteína que actúan en trans.
Las selenoproteínas
Las selenoproteínas son proteínas que presentan selenocisteína en su estructura. El codon de la Sec es UGA, un codon de parada. Este hecho deificulta la identificación de selenoproteínas. Así pues, un codon TGA codificará para Selenoproteínas siempre y cuando existan elementos SECIS (Selenocystein insertion sequence) en el extremo 3' UTR del mRNA.
Los elementos SECIS no presentan un patrón de secuencia característico pero sí una estructura "hairpin-like-setructure" común.
 |
Se han encontrado selenoproteí nas en los tres reinos de la vida, pero no en todas las especies de bacterias (procariotas), archaeobacterias o eucariotas.
La mayoría de las selenoproteínas caracterizadas son enzimas que catalizan reacciones de reducción/oxidación (redox), las cuales contienen selenocisteína en su centro activo.
Las selenoproteínas con función conocida juegan papeles críticos en variedades de procesos biológicos, y muchas de ellas están implicadas en la defensa antioxidante.
Dos de las glutatión peroxidasas (GPx) protegen a las células frente al daño peroxidativo mediante la reducción del peróxido de hidrógeno y los hidroperóxidos de ácidos grasos. Otro miembro de la familia de las GPx, la glutatión peroxidasa de hidroperóxidos de fosfolípidos (PHGPx) reduce los hidroperóxidos de fosfolípidos, colesterol, y ésteres de colesterol, protegiendo así a las células frente a la peroxidación de los lí pidos de membrana. La PHGPx también juega un papel estructural en la cápsula mitocondrial de los espermatozoides maduros.
En mamíferos, hay tres tiorredoxin reductasas que participan en la homeostasis redox a nivel celular mediante la reducción de tiorredoxina y otros sustratos.
Otras óxido-reductasas que contienen selenocisteína incluyen a la familia de las desyodinasas, implicadas en el metabolismo de las hormonas tiroideas, y a la selenofosfato sintetasa 2 (SPS2), que sintetiza el donador de selenio para la biosíntesis de la selenocisteína.
SelR está descrita como una metionina sulfóxido reductasa. Y a la proteína plasmática SelP también se le ha asociado una función antioxidante.
Varias selenoproteínas no tienen una actividad enzimática conocida, incluyendo SelW (expresada en músculo cardíaco y esquelético) y Sel15 (implicada en la prevención de cáncer de próstata).2



