SELENI I SELENOPRTOEÏNES
El Seleni (Se) és un micronutrient essencial involucrat en diversos processos biològics, com la senyalització cel·lular, el sistema immunitari, la resposta davant l’estrès oxidatiu i la síntesi d’hormones tiroidees. Tot i ser tòxic per a l’organisme en proporcions elevades, la seva deficiència pot portar al desenvolupament de nombroses fisiopatologies, incloent malalties coronàries, trastorns neuromusculars, infertilitat i inflamació [1].
El seleni es troba present en les selenoproteïnes, aquelles que tenen com a mínim un aminoàcid amb seleni: les selenocisteïnes. Aquestes tenen l’estructura usual de les cisteïnes però, enlloc del sofre que forma el grup tiol de la cadena lateral, es troba un àtom de Seleni en aquesta posició, que formarà un grup seleniol. Aquests aminoàcid està codificat pel codó UGA, que normalment opera com a codó d’STOP per a aturar la traducció, i és per això que es requereix d’una maquinària específica per a reconèixer el codó UGA com a codificant en un procés que necessitarà un element d’inserció de la seqüència Sec (SECIS o Sec insertion sequence) [2, 3].

Figura 1: Estructura de la cisteïna i la selenocisteïna
Síntesi de selenoproteïnes
La síntesi de les Selenoproteïnes requereix en primer lloc el reconeixement de la seqüència UGA com a codificant, a través del reconeixement dels SECIS, i en segon lloc la inserció de Sec mitjançant un tRNA portador d’aquesta: Ser-tRNA-Sec.
Per començar, cal incorporar el residu de Seleni al tRNA-Sec per a que aquest passi a la proteïna. Primer el residu Serina del tRNA-Sec és fosforilat per O-fosforeil-tRNA-Sec quinasa (PSTK) formant l’intermediari PSer-tRNA-Sec, a la vegada que selenofosfat sintasa (SEPHS) catalitza la producció de selenofosfat (H2SePo-3), preparant el seleni per a ser incorporat a la cadena d’aminoàcids. Per últim, s’afegeix el seleni fosforilat a la fosfoserina per mitjà de la seril-tRNA sintasa (SecS) [4, 5, 6].
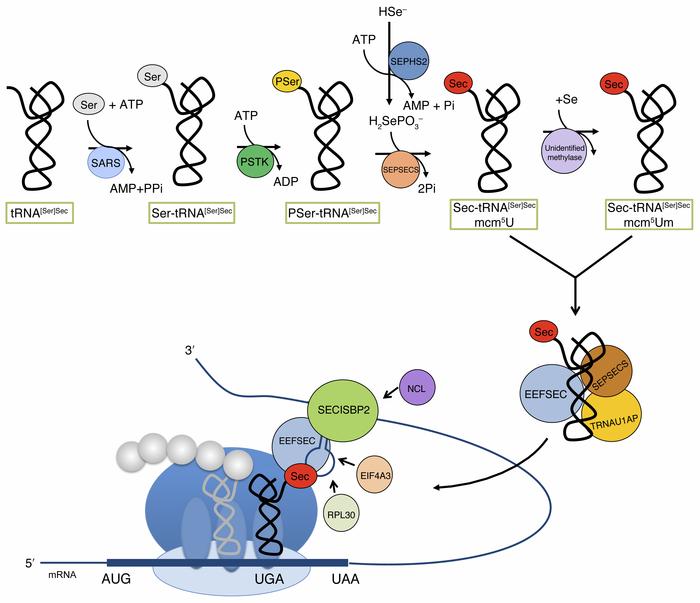
Figura 2: Mecanisme de síntesi de les selenoproteïnes.
Per a poder incorporar Sec des del tRNA-Sec a la seqüència proteica cal el reconeixement de SECIS. Aquests consisteixen en seqüències d’uns 60 nucleòtids que es troben a la regió 3’-UTR del mRNA i formen una estructura de stem-loop que servirà com a lloc d’unio per al complex proteic SBP2 (SECIS-binding protein 2). Seguidament, SBP2 interacciona amb eEFsec, factor d’elongació específic de tRNA-Sec, que es trobarà unit a aquest i permetrà que aquest finalment incorpori Sec a la nova selenoproteïna [7, 8].
Famílies de selenoproteïnes
El principal objectiu d'aquest estudi és predir totes les proteïnes que contenen Sec, les proteïnes necessàries per a la síntesi d'aquestes i les què s'encarreguen de la incorporació de Sec que es troben a Xiphophorus hellerii. Per aconseguir el selenoproteoma d'aquest peix, s'ha comparat el genoma seu genoma amb al d'una espècie que utilitzem com a referència, en aquest cas, el peix zebra (Danio rerio).
Una cosa molt important a tenir en compte per a una comprensió transversal d'aquest estudi és que les espècies marines presenten normalment uns selenoproteomes més grans que els organismes terrestres. Així doncs, els peixos ossis tenen segments duplicats degut a un event de duplicació del genoma sencer, coneguda com a Ts3R. És per aquesta raó que els humans presenten 24 selenoproteïnes quan, per exemple, a Danio rerio hi ha 38 selenoproteïnes[9].
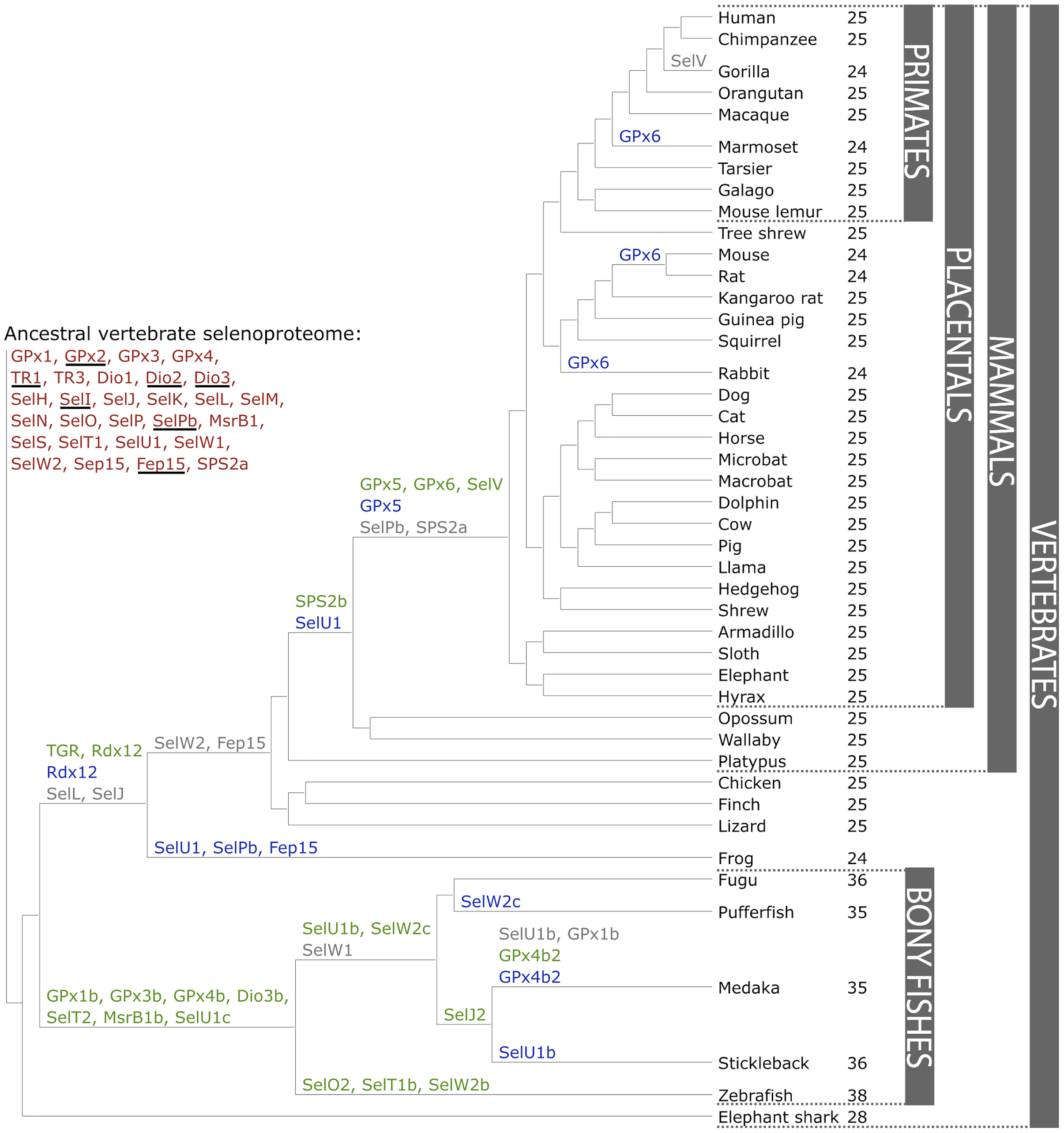
Figura 3: Filogènia selenoproteïnes. En vermell: selenoproteoma ancestral en vertebrats. En verd: aparició de nova selenoproteïna. En blau: canvi de Sec per Cys. En gris: pèrdua de selenoproteïna.
15 kDa selenoprotein (Sel15)
Va ser de les primeres selenoproteïnes a ser identificada i es va anomentar 15-kDa en un principi, donada la seva massa molecular. S’expressa regulada segons la ingesta de Seleni ala dieta, i ho fa en diversos teixits, sobretot en el cervell, pulmons, testicles, fetge, tiroides i ronyó. A seva funció no està clara, tot i que es creu que està relacionada amb el correcta plegament de glicoproteïnes donada la seva localització transmembrana en el reticle endoplasmàtic i el seu centre actiu, consistent en una Sec continguda en una seqüència amb capacitat reductora [10, 11].
SEL E és membre de la família SEL15 i és probable que hagi sorgit com a duplicació d’un gen. Només es troba en el reticle endoplasmàtic dels peixos i la seva funció, de moment, no acaba d’estar clara [10].
Glutathione peroxidase (GPx)
Aquesta va ser la primera família en mamífers en incorporar el seleni en forma de Sec al seu lloc catalític. S’encarreguen de la reducció del peròxid d’hidrogen i hidroperòxids orgànics, protegint així les cèl·lules de l’estrès oxidatiu. En humans es coneixen 8 GPx, 5 de les quals són selenoenzims, i 3 contenen cisteïna, enlloc de selenocisteïna. Estan incloses dins aquesta família GPx1, proteïna citosòlica; GPx2, enzim especí-fic gastrointestinal; GPx3, enzim que actua sobre lípids oxidats; GPx4, fosfolípid hiperperòxid glutatió peroxidasa; GPx6, localitzada únicament a l’epiteli olfactori. Les dues homòlogues en cisteïna son GPx5, d’expressió restringida a l’epidídim, i GPx7. Les principals diferències entre aquestes són la seva distribu-ció i la seva especificitat pel substrat, mentre que en comú tenen el lloc catalític conservat que conté Sec, Gln i Trp, que funcionarà per oxidació-reducció consecutiva durant el cicle catalític [10, 12].
SEL M és una selenoproteïna relacionada amb Sel15, amb un residu Sec a la seqüència –CXXU- a la regió N-terminal, pel que té funció oxidoreductora. S’expressa en major proporció a la glàndula tiroides i al cervell, i en menys concentració al miocardi, pulmons, fetge, úter i placenta [12].
Iodothyronine deiodinase (DIO)
Consisteix en 3 oxidoreductases distribuïdes de manera diferencial que catalitzen la activació inactivació de les hormones tiroidees T3, T4 i rT3, per mitjà del control de la expressió gènica d’aquestes a través del receptor d’hormona tiroidea. Es tracta de proteïnes integrals transmembrana (DIO1 i DIO3 a la membra-na plasmàtica, DIO2 a la membrana del reticle endoplasmàtic) que tenen la Sec en el seu centre actiu. DIO1 es troba a la membrana citoplasmàtica, i s’expressa principalment al fetge, ronyó, glàndula pituïtària i tiroide; DIO2 ho fa a la glàndula tiroide, al sistema nerviós central i al múscul esquelètic, i DIO3 és predominant en l’úter durant la gestació, placenta i pell i cervell del nounat. Aquestes hormones regulen diversos processos metabòlics, com termogènesi, el creixement, l’audició, i són indispensables per al correcte desenvolupament del cervell en el període fetal [10, 12].
Selenoprotein I (SELENOI)
Es tracta d’una proteïna que només està present en vertebrats amb 7 dominis transmembrana 3 residus d’Asp conservats que són clau per a la seva activitat catalítica. Catalitza la síntesi de fosfatidiletanolamina a partir de CDP-etanolamina, essent essencial per al manteniment de les membranes de vesícules[13].
Selenoprotein J (SELENOJ)
Aquesta selenoproteïna només està present en peixos de la classe Actinopterigi i en els eriçons de mar. La característica principal d’aquesta proteïna és que, a diferència que la resta de selenoproteïnes, té una funció estructural, actuant com a cristalina. En Danio rerio s’expressa durant el desenvolupament al cris-tal·lí [14].
Selenoprotein K I S (SELENOK i SELENOS)
SEL K només està present en peixos de la classe Actinopterigi i en els eriçons de mar. La característica principal d’aquesta proteïna és que, a diferència que la resta de selenoproteïnes, té una funció estructural, actuant com a cristalina. En Danio rerio s’expressa durant el desenvolupament al cris-tal·lí [15].
SEL S indueix la seva expressió com a resposta a estrès al reticle endoplasmàtic, a través d’un element de resposta a estrès que es troba dins el promotor de Sel S i que cursa per la via del NFB causant la degradació de les proteïnes malament plegades. A més, també està involucrat en el control de la producció de les citoquines inflamatòries IL-6 i TNF en macròfags, tenint un paper clau en el control de la resposta inflamatòria [10].
Selenoprotein L (SELENOL)
La Selenoproteïna L conté característicament 2 residus de Sec (domini Tiroredoxina) i està present en eucariotes aquàtics: peixos, invertebrats i bacteris marins [16].
Selenoprotein N (SELENON)
És la única Selenoproteïna descoberta fins ara que està lligada directament a una malaltia, essent les se-ves mutacions a la regió 5’UTR i SECIS característicament relacionades amb diverses miopaties que cursen amb hipotonia, feblesa, rigidesa de la columna vertebral i aturada respiratòria. Sel N es troba expressada en tots els teixits i consisteix en una glicoproteïna transmembrana del reticle endoplasmàtic [10].
Selenoprotein O (SELENOO)
Conté un únic residu de Sec a l’extrem C-terminal i es troba a al membrana mitocondrial. Està àmpliament distribuïda però la seva funció encara és desconeguda [16].
Selenoprotein P (SELENOP)
És la segona selenoptroteïna més gran en plasma després de GPx3, i s’estima que conté el 50% del Seleni en plasma. LA seva producció es dóna la fetge, d’on és excretada en forma glicosilada, però és detectada en tots els teixits. Aquesta selenoproteïna incorpora més d’un Sec en la seva estructura, tenint 10 Secs en humans i 17 en el cas del seu homòleg en Danio rerio. El seu paper principal és el transport de Seleni a teixits remots. A més a més, s’han trobat evidències de que podria servir com a quelant de metalls pesants, formant complexos amb el Seleni que són un factor de protecció de neurotoxicitat i protegint contra la oxidació i nitració mediada per peroxinitrit [17, 10].
Selenoprotein R (MSRB)
Catalitza la reducció de metionina oxidada a metionina. Es divideixen en MsrA i MsrB, segons l’especificitat que presenten per al substrat. Dins de la família, MsrB1 és la única que és realment una selenoproteïna ja que conté un residu de Sec al principi actiu, mentre que la resta formen part de la maquinària de síntesi d’aquestes. En general, es localitzen al nucli i al citoplasma [18].
Selenoprotein U (SELENOU)
Es tracta d’una proteïna restringida a vertebrats, i trobem homòlogues que han perdut la selenocisteïna. La seva funció està relacionada amb l’activitat antioxidant a través de processos d’oxidació-reducció [17].
Selenoprotein W, T, H, V
SEL W és una selenoproteïna de 9,5 kDa, amb el residu Sec en l’extrem N-terminal formant part de la seqüència reductora –CXXU-. És expressada en tots els teixits i amb expressió controlada pels nivells de Seleni. Es localitza sobretot al citoplasma i una petita part es troba ancorada a la membrana cel·lular, en ambdós casos unint-se al glutatió amb una gran afinitat i per tant col·laborant en la protecció contra l’estrès oxidatiu [10].
SEL T es localitza a l’aparell de Golgi i al reticle endoplasmàtic i s’expressa durant el desenvolupament embrio-nari i els teixits adults. Conté la seqüència –CXXU-, pel que té funció de regulació d’oxidoreducció a través del control de diversos gens que redueixen l’estrès oxidatiu [19].
SEL H té diverses funcions, entre les que trobem el desenvolupament de diversos òrgans com fetge, tracte digestiu i pàncrees, així com el manteniment de la homeòstasis cel·lular en processos d'oxidació-reducció. Està a més molt conservat en vertebrats i es localitza predominantment al nucli [20].
SEL V és de les últimes selenoproteïnes trobades i es creu que poria ser una duplicació de SEL W. La seva funció és per ara desconeguda, i es troba únicament a la placenta dels mamífers [10].
Thioredoxin reductase (TXNRD)
Són oxidoreductases catalitzen la reducció de la Tioredoxina oxidada. El sistema de Tioredoxina regula l’activitat de NF-KB, AP-1, p53 i el receptor de glucocorticoides (en tots els casos són factors de transcripció que contenen cisteïna en el seu lloc d’unió al DNA), i per tant té un paper molt important pel que fa a la regulació de la proliferació cel·lular i la carcinogènesi.
Trobem 3 TXNRD, cadascuna amb una localització característica: TXNRD1 es torba al citosol i és necessària per al desenvolupament embrionari; TXNRD2 té localització mitocondrial i determina en part el pas de fase G1 a S durant el cicle cel·lular; i TXNRD3 és una Tioredoxina glutatió reductasa específica dels testicles [12, 17].
Maquinària de síntesi
Selenophosphate synthetase (SEPHS)
Involucrat en la síntesi de Selenoproteïnes, aquest enzim catalitza la producció de selenofosfat (H2SePo-3), preparant el seleni per a ser incorporat a la cadena d’aminoàcids [10].
tRNA Sec 1 associated protein 1 (SECp43)
Pren part en el reconeixement de l’estructura SECIS i la incorporació de Sec a la proteïna formant un complex multiproteic amb tRNA-Sec i SLA (soluble liver antigen) [21].
Eukaryotic elongation factor (eEFsec)
Es tracta d’un factor d’elongació de la translació necessari per a la incorporació del Sec a les proteïnes, permetent la incorporació del Trna-Sec al ribosoma [22].
SECIS binding protein 2 (SBP2)
Complex proteic SBP2 (SECIS-binding protein 2). Seguidament, SBP2 interacciona amb eEFsec, factor d’elongació específic de tRNA-Sec, que es trobarà unit a aquest i permetrà que aquest finalment incorpori Sec a la nova selenoproteïna [7, 23].
Phosphoseryl-tRNA kinase (PSTK)
La seva funció és la fosforilació del residu Serina del tRNA-Sec, formant l’intermediari PSer-tRNA-Sec per a que SecS pugui transferir la Sec al tRNA. El seu paper clau en la síntesi de les Selenoproteïnes fa que es trobi àmpliament conservat en Archaea i Eucariotes [6].
Selenocysteine synthase (SecS)
SecS consisteix en una proteïna de la família de transferases dependents de fosfat que media la incorporació del seleni a la fosfoserina de PSer-tRNA-Sec, deixant-la preparada per a que posteriorment introdueixi la Ser a la cadena d’aminoàcids [24].
Xiphophorus hellerii
Xiphophorus hellerii, també conegut com a "cua d'espasa", és una espècie de peix nativa de l'Amèrica Central pertanyant a la superclasse Actinopterygii, ordre Cyprinodontiformes i família Poeciliidae[25]. Al llarg dels anys ha estat força utilitzat com a peix ornamental, i se li ha calificat d'espècie invasora en certs ecosistemes en ser alliberat d'aquaris[26].
Morfologia
X. hellerii es caracteritza per tenir una cua de mida mitjana o gran amb un apèndix caudal llarg i recte, com una espasa, d'on deriva el seu nom comú "cua d'espasa". A més, es pot distingir per una línia lateral de tonalitats fosques o vermelles i per una altra línia adicional també vermella per sobre i per sota de la línia lateral[27].
Té una forma fusiforme, amb el cos allargat i el cap puntiagut. Hi ha molts patrons de colors degut a la gran extensió dels seus hàbitats naturals. El model més comú té un color que es podria definir com a gris oliva, i presenta files d'escates al llarg de la parte mitja del cos que van de verd a blau. La part ventral és de color blanc, i hi ha una línia de tonalitats vermelles als costats a totes les variants regionals. A més, a gairebé totes les poblacions podem trobar puntets o taques vermelles a l'aleta dorsal, i alguns cops això també es pot observar a l'aleta caudal. L'espasa dels mascles normalment és d'un color groc brillant i té una vora en negre més àmplia per la part de sota que per la de dalt. Els individus més vells (3 o 4 anys) poden presentar una espasa totalment negra des de l'aleta caudal fins a la punta de la cua[26].
Apart de les aletes pectorals i pèlviques també consta d'una aleta caudal, una dorsal i una anal.
La mida mitjana d'aquesta espècie és d'uns 2,8 cm, tot i que s'han trobat mascles de 14 cm i femelles de 16 cm.
Ecologia
Hàbitat
Aquest peix viu a corrents ràpides i rius rodejats de vegetació, encara que a vegades es poden observar a aigües càlides i estanys. És un peix epipelàgic, és a dir, viu a la zona de la massa d'aigua on penetra la llum solar. Prolifera a climes tropicals amb temperatures entre els 22 i els 28ºC i a medis amb un pH de 7,0-8,0. No és migratori.
És per aquesta raó que el seu hàbitat natural abarca principalment el riu Nautla, el qual creua l'Amèrica Central des de l'estat de Veracruz, a Mèxic, fins al noroest de Hondures. Així doncs, és natiu de Mèxic, Belice, Guatemala i Hondures. A més també se'l pot trobar a certes àrees dels Estats Units, a l'est de Sud-Àfrica i al lac Otjikoto (Namibia).
Tot i això, múltiples països han assenyalat aquest peix com a causant d'un impacte ecològic advers després d'haver estat introduït a hàbitats no natius, la major part dels casos per alliberament d'aquaris[25].
Alimentació
Es tracta d'un peix omnívor, i per això la seva alimentació es basa principalment en cucs, crustacis, insectes i plantes que troba a la part més superficial de la massa d'aigua[25].
Reproducció
En ser ovovivípars, la fertilització és interna i es dóna a l'oviducte. Després d'un període de gestació d'entre 24 i 30 dies, les femelles tenen de 20 a 200 cries. Aquestes necessiten mínim 8 mesosper alcançar la maduresa sexual, encara que en menys d'un any la majoria ja estan preparades per a la reproducció.
S'ha observat que aquesta espècie tendeix a travessar un procés de reversió de sexe quan es troba sota certes condicions ambientals, essent capaç de passar de femella a mascle[26].
Si vols saber més sobre Xiphophorus hellerii, consulta la nostra pàgina de la Wikipedia.