Introducció
Seleni i selenoproteïnes
El seleni (Se) és un oligolement que correspon al 34è element de la taula periòdica i es troba present al considerat 21è aminoàcid: la selenocisteïna (Sec, U). Aquest aminoàcid és un anàleg de la cisteïna (Cys, C) en el qual s’ha produït un canvi en la cadena lateral: seleni al lloc del sofre. Les selenoproteïnes es van descobrir el 1989 i des de llavors han constituït una important via de recerca. Això és degut a la seva alta reactivitat i al seu potencial com a proteïnes. La majoria d’aquestes proteïnes tenen activitat catalítica amb una acció específica de les selenocisteïnes[1].
Figura 1.Estructures de la cisteïna i la selenocisteïna
Les selenoproteïnes són codificades pel codó TGA gràcies a una maquinària específica necessària per afegir l’àtom de seleni a la selenocisteïna.[2] Adquirim el seleni a través de la dieta, més concretament de les plantes.
La incorporació de la selenocisteïna a les selenoproteïnes requereix un mecanisme diferencial ja que de forma habitual el codó que codifica per aquesta proteïna AUG codifica per un STOP codon.[3] Per aquest motiu tenim un tRNA específic per aquesta funció anomentat tRNASec.[4]
Importància biològica
El seu rol enzimàtic pren importància en processos antioxidants, producció d’hormona tiroidal i en la motilitat dels espermatozoides. El seleni també és necessari per un correcte funcionament del sistema immunitari; diferents estudis l’assenyalen com a un possible regulador tan de la virulència com de la progressió de les AIDS. A més a més, una ingesta elevada de seleni sembla estar relacionada amb una reducció del risc de càncer.[5]
Selenoproteïnes: síntesi, evolució i famílies
Síntesi
El seleni s’incorpora a l’organisme a través de la dieta. Pateix una sèrie de reduccions, el mecanisme de les quals encara no està clar, fins a arribar al donador actiu de seleni: el monoselenofosfat. Aquest compost converteix el seryl-tRNASec a Sec-tRNASec.
Per altra banda la maquinària necessària per la síntesi de selenoproteïnes necessita un element específic situat a la regió 3’ no traduïda (3’UTR) de l’mRNA que codifica per una selenoproteïna anomenat insreció de selenocisteïna (SECIS). També són necessàries altres proteïnes per dur a terme el procés com el factor d’elongació Sec-específic, SECIS-binding protein 2 (SBP2), proteïna ribosomal L30, 43-kDa RNA binding protein, proteïna antigènica soluble de ronyó i SPS1.[6]
Totes elles treballen conjuntament per tal de poder incorporar la Sec al polipèptid que està sent sintetitzat quan es detecta el codó UGA a les cèl·lules de mamífers[7].
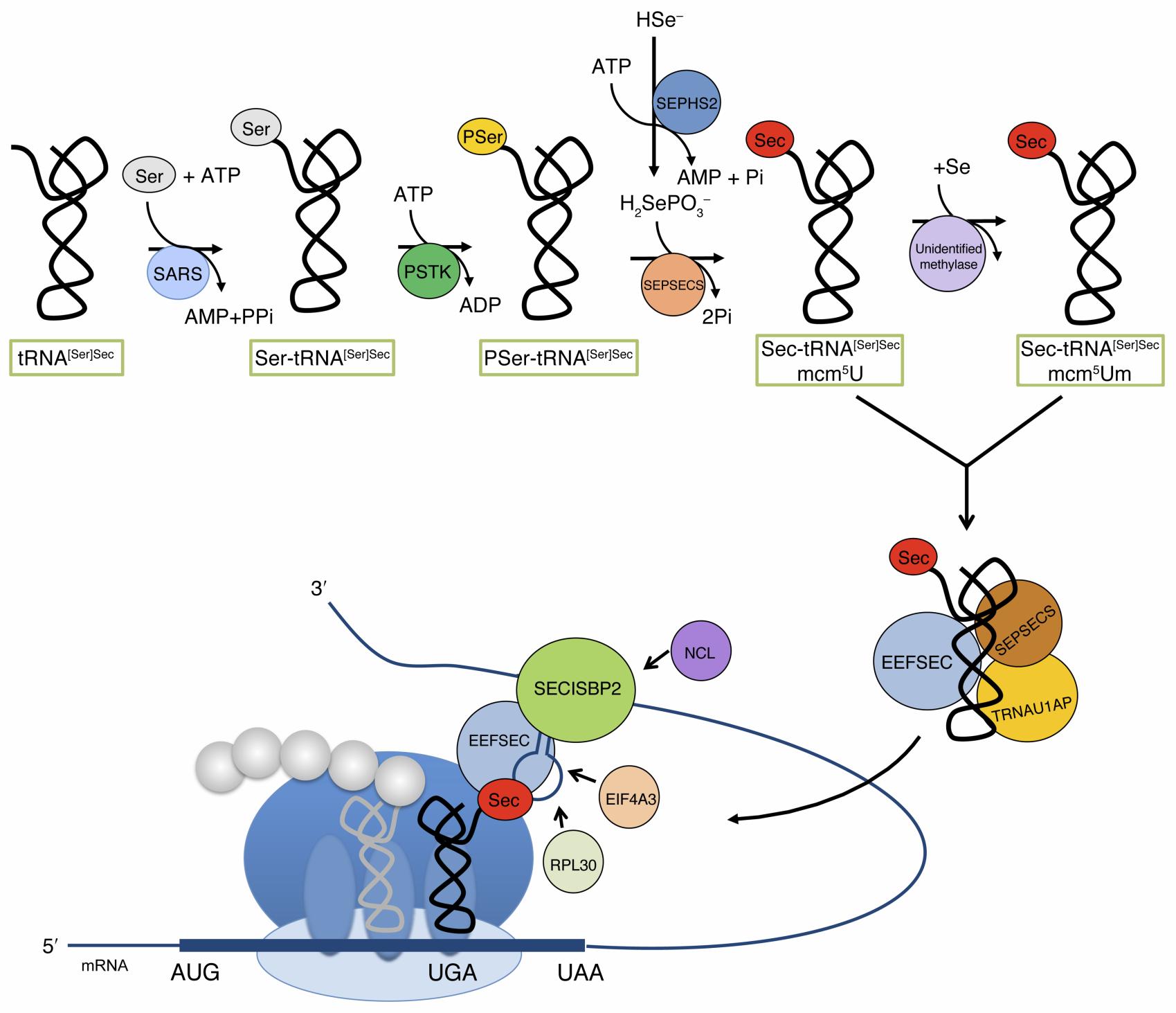
Figura 2.Hipòtesi del mecanisme de biosíntesi de la selenocisteïna i incorporació a les selenoporoteïnes
Evolució
L’anàlisi de diferents selenoproteomes, recull de totes les selenoproteïnes d’un organisme, en 44 organismes diferents han permès detectar una gran variabilitat en les diferents selenoproteïnes que té cada família. D’aquesta manera trobem com hi ha algues verdes amb 20 selenoproteïnes diferents i algues vermelles sense selenoproteïnes. Estudis recents ens diuen que, en general, els organismes aquàtics tenen selenoproteïnes més llargues que els animals terrestres. Alhora els mamífers sembla que hagin reduït l’us de selenoproteïnes. Es van trobar un total de 45 famílies de selenoproteïnes, 28 de les quals es troben en mamífers, tot i que actualment ja se’n coneixen més de 50. 21 d’aquestes es trobaven en tots els vertebrats i les altres només en certs llinatges. Aquesta diferència ens marca una procés dinàmic pel qual obtenim tan noves selenoproteïnes generades per duplicació o altres que es perden o canvien la seva Sec per una Cys[8].
Comparant la seqüència de selenoproteïnes de vertebrats per tal de poder fer un estudi filogenètic es va observar que la selenoproteïna més conservada era la selenoproteïna T (SelT) conservada fins i tot a nivell de nucleòtids.
A més a més dins els peixos trobem que els actinopterigis han patit una duplicació del genoma, motiu pel qual també trobem duplicacions de selenoproteïnes.[9]
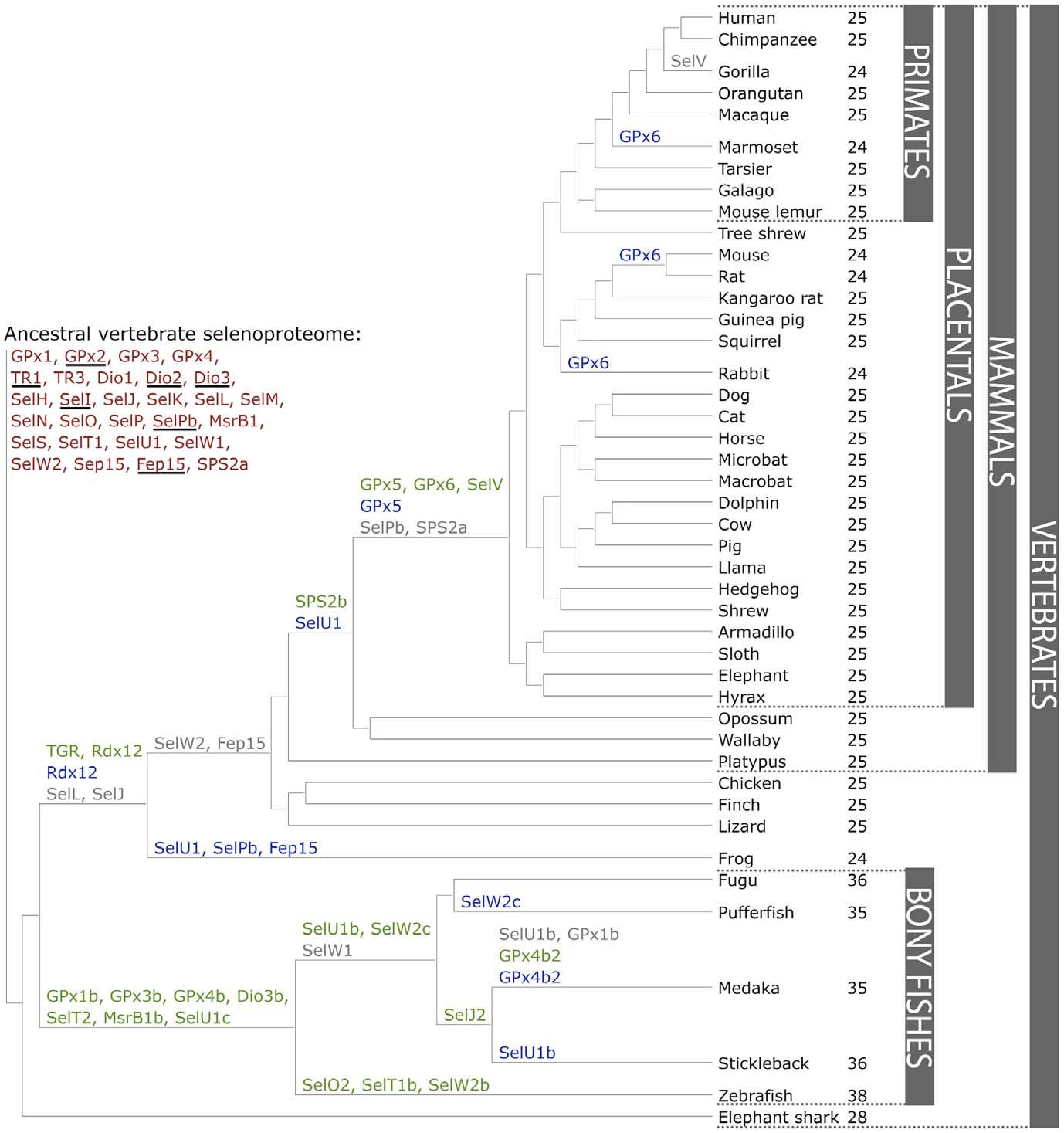
Figura 3.Evolució del selenoproteoma en vertebrats
Famílies de selenoproteïnes
GPx: Família glutatió peroxidases.[10] Es troba composta per 8 enzims els quals conserven una cisteïna catalítica propera a l’extrem N-terminal, anomenada cisteïna peroxidàtica (CysP-S−). Redueixen hidroperoxidases i peroxinitrits. Amb aquesta funció, contribueixen al manteniment de la homeostasis mitjançant reaccions redox. Els mamífers en tenen 8, de les quals són selenoproteïnes: GPx1-4 i GPx6.[11][12]
| GPx1 | Homotetràmer que es localitza al citoplasma. Té com a funció protegir la hemoglobina dels eritròcits enfront l’estrés oxidatiu[13]. |
| GPx2 | Homotetràmer citoplasmàtic que s’expressa sobretot en el fetge y el tracte gastrointestinal. Té com a funció protegir enfront a la toxicitat dels peròxids orgànics ingerits.[12] |
| GPx3 | Homotetràmer que es secreta al plasma la funció del qual es protegir les cèl·lules del dany oxidatiu. Funció d’antioxidant.[11] |
| GPx4 | Glutatió peroxidasa de hidroperòxids de forfolípids. La seva funció és d’antioxidant i de proteïna estructural en els espermatozoides madurs.[14] |
| GPx5 | No és una selenoproteïna. Enzim secretat a l’epidídim per tal de protegir l’esperma.[11][12] |
| GPx6 | Glutatió peroxidasa del tracte olfactori[11]. |
| GPx7 | No és una selenoproteïna. Proteïna secretada[13]. |
| GPx8 | No és una selenoproteïna. Proteïna de membrana.[13] |
DIO:Regulen l’activació o inactivació de l’hormona tiroidea. Trobem principalment tres tipus de ioditironines deionidases.[15]
| Dio1 | Producció d’hormona de forma sistèmica. |
| Dio2 | Producció d’hormona a nivell local. |
| Dio3 | Inactiva la hormona de forma irreversible. |
MsrA:És una selenocisteïna la funció de la qual és desconeguda. La selenoproteïna només es troba en mamífers tot i que té nombrosos homòlegs amb cisteïna.
SelenoR (MsrB):És una selenocisteïna la funció de la qual és desconeguda. La selenoproteïna només es troba en mamífers tot i que té nombrosos homòlegs amb cisteïna.[12]
SelenoW: S’expressa a múltiples teixits tot i que no es coneix la seva funció. Trobem diferents homòlegs als organismes vertebrats. Conserven un motiu Cys-x-x-Sec[11].
SelenoV: Aquesta selenoproteïna només s’ha localitat als testis però no es coneix la seva funció. Es creu que és una duplicació de la selenoproteïna SelW. Conserven un motiu Cys-x-x-Sec.[10]
SelenoH: Factor de transcripció.Protegeix les neurones contra el dany causat per UVB inhibint l’apoptosi pormoguent l’activitat mitocondrial. Conserven un motiu Cys-x-x-Sec
SelenoT:Dóna protecció a les neurones dopaminèrgiques en el Parkinson i també controla l’homestasi de la glucosa a les cèl·lules beta-pancreàtiques. Conserven un motiu Cys-x-x-Sec.
SelenoM i SelenoE (Fep15):Aquestes selenoprteïnes es poden agrupar dins la mateixa família ja que presenten un domini thioredoxin-like i una superfície amb un motiu redox accessible.[10]
| SelenoM | La funció concreta d’aquesta proteïna és desconeguda. Es localitza a la regió perinuclear i s’expressa molt a les cèl·lules neuronals. Per aquest motiu d’hipotetitza que podria tenir una funció en malalties neurodegeneratives. També d’ha vist que la seva delecció en ratolins dóna un fenotip obès, raó per la qual es creu que la seva funció pot estar també relacionada amb la regulació del metabolisme. |
| SelenoE | Només s’ha detectat en peixos i, tot i que la seva funció exacte no es coneix, es creu que podria estar involucrada en funcions úniques d’aquests organismes. |
Seleno15:Aquesta proteïna és una thioredoxin-like situada al reticle endoplasmatic que regula el correcte plegament de les glicoproteïnes. La seva pèrdua provoca cataractes. el que fa pensar que té un paper rellevant durant el plegament de les glicoproteïnes de la còrena.[11]
SelenoP:Té relació amb el transport extracel·lular del seleni o amb la seva acció antioxidant.[10] Majoritàriament d’expressa al fetge, que la secreta en plasma, tot i que la trobem present en molts teixits. Sembla que podria proveir tan el cervell com els testis[11].
SelenoO:Es localitza a la mitocondria on controla reaccions redox. És la selenoproteïna més llarga en mamífers que compta amb ortòlegs, fins i tot, en organismes protists[16].
SelenoU:Funció desconeguda. S'hioptetitza que pot tenir una funció redox[10].
SelenoI: Involucrada en el manteniment de les membranes vesiculars, regulació del metabolisme lipídic i plegament de proteïnes.
SelenoJ: Té una distribució molt concreta ja que no es troba en altres vertebrats, ni com a selenoporteïna ni com a un homòleg amb cisteïna. Té la particularitat que no té una funció enzimàtica com la majoria de les selenoproteïnes sinó més aviat de caire estructural, segons estudis computacionals[17].
SelenoS i SelenoK:Aquesta família s'agrupa per similitud estructural tot i que són distals entre elles.
| SelenoS | Selenoproteïna involucrada en la regulació de la funció del reticle endoplàsmic. Concretament, hi ha estudis que reflexen la seva implicació amb el transport intracel·lular de membranes alhora que manté els complexes proteics associats a membranes ancorant-los al reticle endoplasmàtic[18]. |
| SelenoK | Aquesta selenoproteïna està involucrada amb el manteniment de l’homeostasi del reticle endoplasmàtic. També es sap que està involucrada en processos de mobilització de calci durant la inflamació durant la resposta immunitària. |
SelenoL: Es troba a la superfamília de les thioredoxines però amb la paculiaritat que els peixos són els únics vertebrats que la presenten. La característica comuna entre aquestes és la thioredoxina, on tenim UxxU (sent U una selenocisteïna i les x aminoàcids qualsevols[19]).
SelenoN: La seva funció exacte és desconeguda. Es troba en molts teixits durant desenvolupament embrionari i es creu que podria tenir un paper rellevant en la miogènesi: durant en l'embriogènesi i en l'adult.
Tioredoxines reductases (TXNDR):Aquestes proteïnes són oxireductases del nucleòtid piridina. Redueixen tioredoxines entre d’altres substrats alhora que tenen un paper important pel que fa al metabolisme del seleni i a la protecció davant l’estrès oxidatiu. Se’n coneixen tres formes[20].
Famílies de maquinària
SEPHS:La seva funció és generar el selenofosfat necessari per incorporar el seleni a la selenocisteïna[21]. Trobem dues formes paràlogues de la proteïna[22]:
| SEPHS1 | Sintetiza el selenofosfat a partir de selenide i ATP. La seva funció més concreta però no està clara. Podria tenir un efecte més en el reaprofitament del seleni. |
| SEPHS2 | La seva funció és generar el selenofosfat necessari per incorporar el seleni a la selenocisteïna. La seva interacció però sembla que podria ser més rellevant pel que fa a la creació de proteïnes de novo. |
eEFsec:Aquesta proteïna de maquinària de síntesi de selenoproteïnes pren el paper de factor d’elongació específic per selenocisteïnes[21].
PTSK:Fosforila específicament seryl-tRNASec per tal de crear un intermediari actiu de la síntesi de selenocisteïnes[21].
SBP2:Aquesta proteïna s’uneix a l’element SECIS el qual ha estat estimulat específicament per un factor d’elongació Sec-específic[22].
SECp43:Aquesta proteïna presenta un domini d’unió a RNA. En aquest cas la unió es dóna específicament al tRNASec. La seva funció és ajudar-lo a madurar[21][22].
SecS:Accepta la molècula de selenofosfat a la serina portada per SEPHS2[21][22]
SBP:Aquesta proteïna reconeix els elements SECIS presents a l’mRNA de les selenoproteïnes. Ajuda a reclutar la maquinària proteica necessària per a la correcta síntesi[21].
Astyanax mexicanus
Morfologia
Es distingeixen dues poblacions d'Astyanax mexicanus: la població de superfície (aspecte similar als peixos de les profunditats oceàniques) y la població de les coves submergides[23].
Els A.mexicanus que habiten coves submergides properes a la costa es caracteritzen per presentar: pèrdua de tamany, degeneració ocular, pèrdua de pigmentació increment del nombre i tamany dels neuromasts, i increment del nombre de papil·les gustatives i del nombre de cèl·lules en elles.[24]
Hàbitat
Geogràficament A.mexicanus viu a zones de clima subtropical, concretament a Nord-Amèrica i Mèxic. Hi ha dues poblacions diferenciades, una que habita en les coves costeres sumergides i l'altre que habita les superfícies aquàtiques[24]
Model d'investigació
L’Astyanax mexicanus, també conegut com a tetra mexicà, és un peix de rellevant importància com a model de laboratori degut a l’existència de dues poblacions separades fa 2-3 milions d’anys, el que permet estudiar diferents fenotips segons la pressió evolutiva a la qual han estat sotmeses.
La seqüenciació del genoma d’aquest organisme es va dur a terme amb material genètic extret de la primera generació de dos adults salvatges de la cova Pachón a Mèxic. Es va escollir aquesta cova degut a la radicalitat de fenotips que presenta. El genoma s'ha obtingut utilitzant Ensembl i la seqüenciació dels transcrits d’RNA. S’han predit un total de 23.042 gens codificants per proteïnes i d’aquests 16.480 són ortòlegs directes amb l’organisme model Zebra Fish.
En aquesta mateixa línia, permet seguir qüestions rellevants respecte al procés d’adaptació que pateixien els organismes quan es troben en nous ambients.
Per altra banda, s’han fet estudis amb A. mexicanus amb tècniques de genètica molecular per estudiar aspectes com l’embriogènesi o comparar-lo amb un altre organisme model com Zebra fish[24].
Classificació filogenètica
| Súper-regne | Eukaryota |
| Regne | Animalia |
| Filum | Chordata |
| Classe | Actinoptegygii |
| Ordre | Characiformes |
| Família | Characidae |
| Gènere | Astyanax |
| Espècie | Astyanax mexicanus |
Per a més informació sobre l'Astyanax mexicanus adreçar-se a Viquipèdia.