Què són les selenoproteïnes:
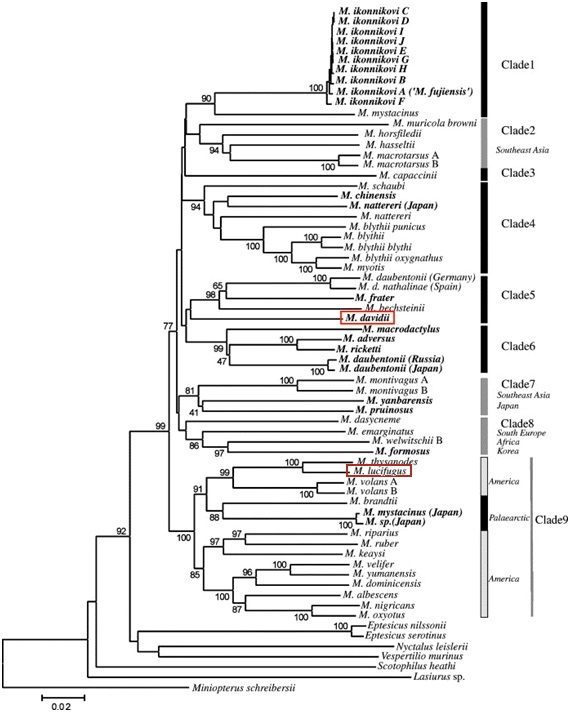
Les selenoproteïnes són proteïnes que contenen una selenocisteïna en la seva seqüència. La selenocisteïna (Sec) es considera el 21è aminoàcid, i consisteix en una cisteïna en la qual s’ha substituït el radical sulfur per un àtom de seleni (Se) (Fig.1). La selenocisteïna és traduïda pel codó UGA, el qual suposaria un STOP en el procés de traducció de proteïnes corrent. Per tal d’evitar aquest aturament de la traducció i introduir la selenocisteïna, les cèl·lules que contenen selenoproteïnes necessiten una maquinària de traducció específica per aquest sistema6.
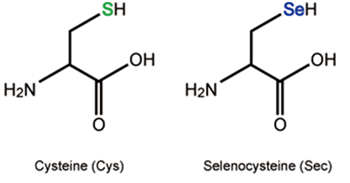
Fig 1. Estructura d'una selenocisteïna12.
Podem trobar selenoproteïnes en bacteris i eucariotes, però no en totes les espècies d’aquests regnes. En alguns organismes, com les plantes i els llevats, existeixen proteïnes semblants a les selenoproteïnes però que no ho són, ja que en el lloc on hi hauria d’haver la Sec, hi trobem una cisteïna. Aquestes proteïnes s’anomenen homòlegs de cisteïna, i són capaces de realitzar la mateixa funció que una selenoproteïna. Tot i així, la importància de les selenoproteïnes és que el seleni és més reactiu que el sofre, i per tant la Sec dóna més eficiència que la cisteïna en les reaccions en les quals participa. Així doncs, una mateixa proteïna pot ser una selenoproteïna en una espècie i un homòleg de cisteïna en una altra espècie; això s’ha observat per exemple en la proteïna glutatió peroxidasa 6 (GPx6), que conté selenocisteïna en humans i un homòleg de cisteïna en ratolins. És molt important tenir això en compte, ja que pot ser un factor de confusió a l’hora d’identificar selenoproteïnes en una espècie5.
Moltes selenoproteïnes tenen funcions biològiques importants com oxidoreduccions, defensa antioxidant, senyalització redox, metabolisme d’hormones tiroidees i participació en resposta immunitària. En la majoria d’aquests processos, les selenoproteïnes actuen provocant reaccions redox, en les quals la selenocisteïna forma part de la regió catalítica i és essencial per a l’acció de la proteïna. A continuació veurem un resum de la funció de les selenoproteïnes més rellevants que podem trobar en humans i la majoria de mamífers (només aquelles que no participen en la maquinària de traducció, les quals veurem més endavant)8:
Selenoproteïna de 15 kDa (Sel15): estudis en ratolins fan pensar que aquesta selenoproteïna té funció redox i pot estar involucrada en el control de qualitat del plegament de les proteïnes.
Família de les glutathione peroxidases (GPx): aquesta família inclou tant selenoproteïnes com homòlegs de cisteïna, alguns dels quals varien segons l’espècie. Per exemple, en humans trobem vuit GPx, de les quals cinc són selenoproteïnes. Aquestes selenoproteïnes estan entre els enzims antioxidants més importants en humans, participant en la detoxificació del peròxid d’hidrogen.
Família de les iodothyronine deiodinases (DI): aquest grup de proteïnes participen en l’activació i inactivació de les hormones tiroidees mitjançant l’extracció d’àtoms de iode dels compostos. DI2 és capaç d’activar-les per conversió de la prohormona tiroxina (T4) a triiodotironina (T3). DI3 en canvi inactiva les hormones convertint-les en reverse triiodotironina (rT3). Per que fa DI1 és capaç de fer ambdós processos.
Methionine sulfoxide reductase A (MsrA): es creu que la seva funció és la reparació de dany oxidatiu produït en proteïnes mitjançant la reacció de reducció de sulfòxid de metionina a metionina. En humans es tracta d’un homòleg de cisteïna.
Selenoproteïna H (SelH): es troba situada al nucli i es creu que té funció antioxidant.
Selenoproteïna I (SelI): la seva funció encara és desconeguda.
Selenoproteïna K (SelK): es localitza al reticle endoplasmàtic i s’ha trobat altament expressada en el cor, on es creu que funciona com a antioxidant.
Selenoproteïna M (SelM): es troba expressada a tot l’organisme i en especial a l’encèfal, on també tindria funció protectora contra el dany oxidatiu.
Selenoproteïna N (SelN): la seva funció és desconeguda, tot i que sembla ser que està força expressada en l’etapa pre-natal i s’ha relacionat amb els procés de formació de la musculatura (miogènesi) i amb el seu funcionament post-natal.
Selenoproteïna O (SelO): aquesta proteïna es troba àmpliament extesa en molts organismes, però la seva funció no es coneix en cap d’ells.
Selenoproteïna P (SelP): aquesta selenoproteïna és molt característica pel fet de presentar múltiples selenocisteïnes en la seva seqüència. S’expressa a nivell extracel·lular i s’associa a les cèl·lules endotelials, es creu que té funció antioxidant i de transport de seleni entre diferents òrgans i teixits.
Família de les methionine-R-sulfoxide reductase (SelR): aquesta família de proteïnes també participa en la reducció de residus de metionina oxidats, actuant com a reparador d’enzims. La família està formada per tres proteïnes (SelR1,SelR2 i SelR3), de les quals només la primera és una selenocisteïna.
Selenoproteïna S (SelS): es creu que està involucrada en la regulació de producció de citocines, participant en la resposta inflamatòria.
Selenoproteïna T (SelT): la seva funció encara és desconeguda, tot i que s’ha vist que està més expressada en l'embriogènesi que en l’etapa adulta.
Família de les selenoproteïnes U (SelU): aquesta família de proteïnes (SelU1, SelU2 i SelU3) són selenoproteïnes en algunes espècies de peixos, però en mamífers són homòlegs que contenen cisteïna. La seva funció és desconeguda.
Selenoproteïna V (SelV): s’ha observat que aquesta selenoproteïna s’expressa només en testícles, però la seva funció és encara desconeguda.
Família de selenoproteïnes W (SelW): es coneix que aquestes proteïnes realitzen reaccions d’oxidació-reducció. La família està formada per dues proteïnes: SelW1, que s’expressa principalment a la musculatura esquelètica i al cor, i SelW2.
Família de les thioredoxin reductases (TR): les tres proteïnes que formen aquesta família (TR1, TR2 i TR3) són selenoproteïnes i s’encarreguen de reduir les tioredoxines per tal de fer-les catalíticament actives. Estan implicades en la defensa davant de processos d’estrès oxidatiu.
Biosíntesi de selenoproteïnes:
Com ja hem comentat el codó UGA codifica per la Sec però també indica un STOP en la traducció, amb la qual cosa cal una recodificació d’aquest codó per tal que es pugui introduir l’aminoàcid al polipèptid. Això és possible gràcies a un conjunt de proteïnes que formen una maquinària especial de traducció de selenoproteïnes. Per tal que aquesta maquinària pugui reconèixer en quines proteïnes ha d’incorporar Sec, l’mRNA de les selenoproteïnes conté un motiu en 3’ amb una estructura secundària de bucle anomenat selenocysteine insertion sequence o element SECIS. Aquesta part de la seqüència no es tradueix en sintetitzar la selenoproteïna.
Per a la síntesi de selenoproteïnes, primer cal sintetitzar l’aminoàcid Sec, ja que aquest no es troba lliure a la cèl·lula per evitar que sigui incorporat erròniament en altres proteïnes (Fig.2). En aquest pas hi participen els següents elements i proteïnes2,11:
Selenocysteyl-tRNA (tRNASec): és el tRNA que incorpora la Sec, i on es produeix la síntesi de la pròpia Sec. En primer lloc, s’incorpora un aminoàcid serina al Sec-tRNA (tindrem Ser-tRNASec) mitjançant la Seryl-tRNA sinthetase (SerS), que més tard serà convertit en Sec.
Phosphoseryl-tRNA kinase (Pstk): aquesta proteïna s’encarrega de fosforilar la serina del Ser-tRNASec per poder incorporar el seleni i convertir-la en selenocisteïna.
Selenophosphate synthetase 2 (SPS2): aquesta proteïna, que curiosament és una selenoproteïna, és el donador de seleni del sistema. Aquesta proteïna és capaç de convertir el seleni procedent de la dieta en selenofosfat. SPS1 és una proteïna de la mateixa família que es creu que participa en el sistema de reciclatge de les selenocisteïnes, tot i que el seu paper encara està en dubte i es creu que pot tenir altres funcions no relacionades amb la síntesi de selenoproteïnes.
Selenocysteine synthase (SecS): és la proteïna encarregada de convertir la serina fosforilada del Ser-tRNASec en selenocisteïna, incorporant el selenofosfat que aporta la SPS2. Així obtenim el Sec-tRNASec.
tRNA Sec 1 associated protein 1 (Secp43): aquesta proteïna forma un complex amb SecS, participant també en l’últim pas de formació de la selenocisteïna.
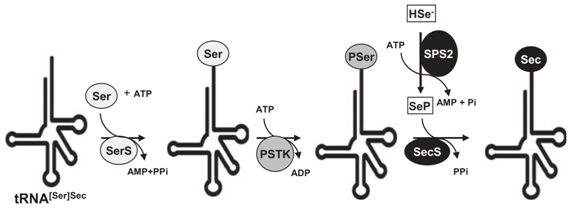
Fig 2. Procés de síntesi de seleneocisteïnes en tRNASec11.
Un cop format el Sec-tRNASec, aquest ha d’incorporar la Sec al polipèptid. En aquest segon pas hi participen, a més de la tRNASec, les següents proteïnes (Fig.3):
SECIS binding protein 2 (SBP2): és una proteïna de 846 aminoàcids que reconeix l’element SECIS de la regio 3’ del mRNA i és capaç d’unir-s’hi.
Eukaryotic Elongation Factor Selenocysteine-specific (eEFSec): aquest factor interacciona específicament amb el Sec-tRNASec però no és capaç d’unir-se a l’element SECIS, per això s’uneix a SBP2 amb el qual forma un complex, fent de pont entre el reconeixement de l’element SECIS i la incorporació del Sec-tRNASec al sistema.
D’aquesta manera es “crida” al tRNA carregat amb la selenocisteïna, que la incorporarà quan trobi el codó UGA. Així doncs, és fonamental que una espècie tingui aquestes proteïnes de maquinària per tal de poder sintetitzar selenoproteïnes.
Fig. 3 Sistema de recodificació del codó UGA en la síntesi de selenoproteïnes1.
Selenoproteïnes en mamífers:
Les selenoproteïnes es troben àmpliament exteses en els vertebrats. L’any 2012 es van detectar 4 subfamílies de selenoproteïnes en els vertebrats, 28 de les quals es van trobar en mamífers8. Segons el mateix estudi, el proteoma ancestral dels vertebrats tindria 28 proteïnes, mentre que el dels mamífers en tindria 25. Al llarg de l’evolució de les espècies, aquests proteomes haurien evolucionat per fenòmens de duplicació gènica, pèrdua de gens o conversió de la Sec a cisteïna, ocasionant que actualment no tots els mamífers ni vertebrats en general tinguin les mateixes selenoproteïnes en el seu genoma (Fig. 4). Es van trobar 21 selenoproteïnes que eren comunes a tots els vertebrats, i aquestes eren: GPx1-4, TR1, TR3, DI1, DI2, DI3, SelH, SelI, SelK, SelM, SelN, SelO, SelP, MsrB1, SelS, SelT1, SelW1 i Sep15.
Cal dir que aquest estudi es va fer amb els selenoproteomes que estaven caracteritzats fins al moment, per tant, en realitzar una predicció de selenoproteïnes en una nova espècie esperaríem trobar resultats similars, però no necessàriament s’haurien conservat exactament les mateixes proteïnes.8
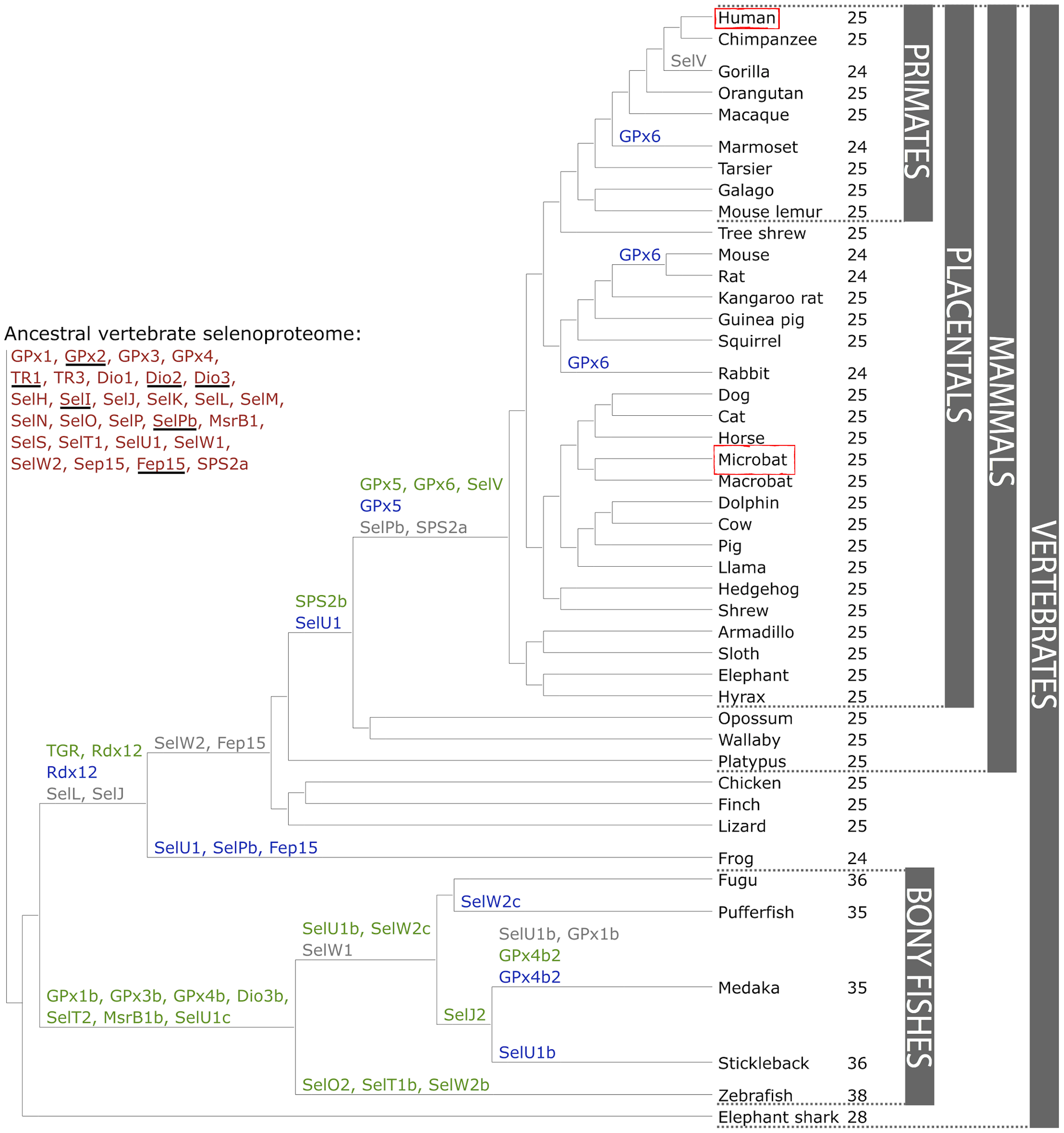
Fig 4. Evolució del selenoproteoma dels vertebrats. En vermell s’indica el selenoproteoma ancestral; en verd es mostren les duplicacions de selenoproteïnes; en gris les pèrdues i en blau les substitucions de selenocisteïna a cisteïna. Al costat del nom de cada espècie trobem el nombre de selenoproteïnes trobades8.
Myotis davidii:
-
Classificació:
- Regne: Animalia
- Fílum: Chordata
- Subfílum: Vertebrata
- Classe: Mammalia
- Ordre: Chiroptera
- Subordre: Microchiroptera
- família: Vespertilionidae
- Subfamília: Myotinae
- Gènere: Myotis
- Espècie: davidii
Myotis davidii és una espècie de ratpenats endèmica a la Xina que sobretot habita en reserves naturals, concretament a les regions de Beijing, Hebei, Nei Mongol, Shanxi, Hubei i Shaanxi4,6.
Aquesta espècie forma part del gènere Myotis, el qual inclou 84 espècies esteses a tot el món. La principal característica d’aquest gènere és que presenten orelles de morfologia similar a la dels ratolins, per la qual cosa solen anomenar-se “mouse-eared bats” en anglès. La família Vespertilionidae a la qual pertanyen es caracteritza per tenir el musell similar als ratolins, i el subordre Microchiroptera fa referència als considerats micro ratpenats. Per últim, cal dir que l’ordre Chiroptera inclou tots els ratpenats, que són els únics mamífers amb capacitat per volar, i constitueix un dels ordres de mamífers més grans en nombre d’espècies (Fig. 5)4.
En aquesta espècie encara no s’han identificat quines selenproteïnes presenta en el seu genoma, però si que s’han estudiat en una espècie del mateix gènere, Myotis lucifugus.