Recerca de selenoproteïnes en protistes:
SelW,MsrA
Carlevaro J.; Casas A.; Eraso A.; Farrés A.; Gamallo B.
Les selenoproteïnes
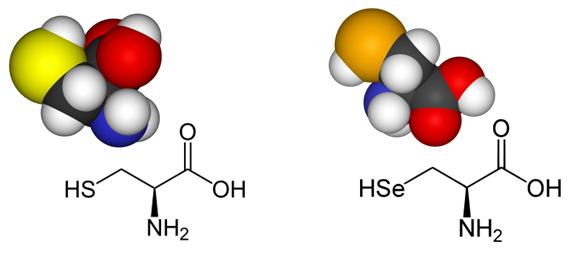
El seleni (Se) és un element nutricional essencial que resulta de vital importància per a la fisiologia d'una gran varietat d'espècies, incloent-hi als humans. Les selenoproteïnes són proteïnes que incorporen selenocisteïna (Sec), l’aminoàcid 21, a la seva estructura primària. L’estructura de la selenocisteïna és com la de la cisteïna però l’àtom de sofre és substituït per un de seleni. El seleni i el sofre tenen reactivitats molt semblants.
Les selenoproteïnes estan involucrades directament en les reaccions redox (oxidació-reducció). Presenten propietats antioxidants, fet que ajuda a prevenir del dany cel•lular davant els radicals lliures. Aquests radicals són productes derivats del metabolisme i s’ha vist que en humans contribueixen al desenvolupament de patologies com el càncer o malalties coronàries. A més, col•laboren en la regulació de la funció tiroidea i tenen un paper destacat en el sistema immunitari.
Als organismes eucariotes, actuen com a enzims que participen en la homeostasis redox i en la defensa davant l’estrès oxidatiu, fet que repercuteix directament sobre la salut dels organismes que els sintetitzen.
Pel que fa als eucariotes unicel•lulars, els anomenats protistes, la distribució de selenoproteïnes és més diversa i desconeguda degut en gran part a la gran diversitat taxonòmica d’aquest grup d’organismes així com a la gran distància filogenètica que els separa. És per això que han estat estudiats i analitzats en el nostre projecte.
La dificultat en la cerca de selenoproteïnes rau en el fet que contenen selenocisteïna (SeC o U), el 21è aminoàcid, un anàleg de cisteïna (Cys) en el qual s’ha substituït l’àtom de sofre per un de seleni. La Sec ve codificada pel codó UGA que generalment constitueix un codó d’STOP. Tanmateix, en presència d’una estructura tridimensional en forma de loop, la SElenoCystein Insertion Sequence (SECIS), a l’extrem 3’ no traduït dels gens, la maquinària de traducció de selenoproteïnes és reclutada i s’evita la terminació. Per aquest motiu, l’anotació de les selenoproteïnes sol ser incorrecte i ha de ser corregida un cop trobades. [1] [2] [5] [6]
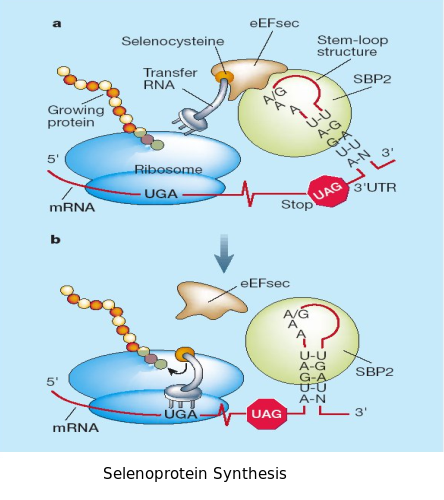
En la biosíntesi de les selenoproteïnes estan implicats un gran nombre d’elements.
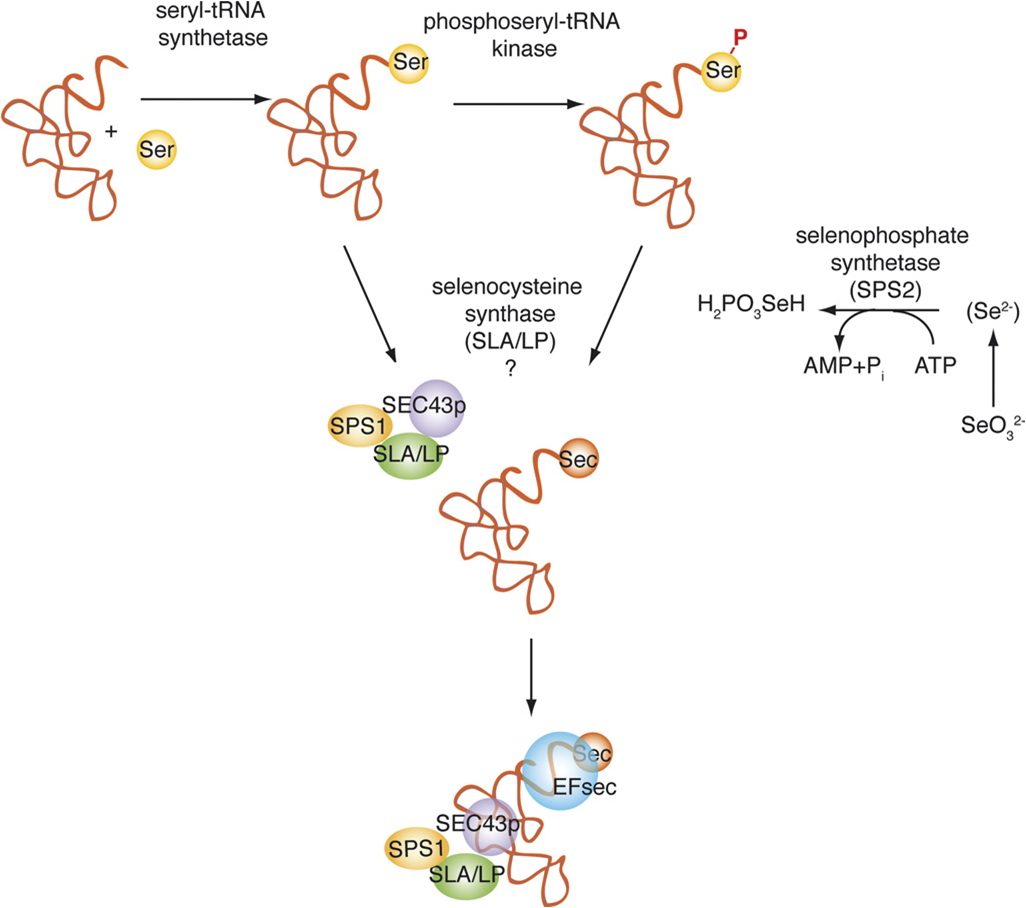
Per a la síntesi de la selenocisteïna són necessaris:
En bacteris, el funcionament és diferent perquè no s'hi troba PSTK. La biosíntesi, doncs, no inclou aquesta fosforilació de la Serina per PSTK (perquè no hi és) i el substrat de SecS és directament seryl-tRNA. En conclusió, PSTK es troba en arquea i eucariotes i no es troba en bacteris, plantes i llevats. El fet que PSTK hagi estat altament conservat al llarg de la evolució suggereix que juga un paper important en la biosíntesi i/o regulació de selenoproteïnes.
I en la seva incorporació a la proteïna intervenen:
Les selenoproteïnes estan involucrades directament en les reaccions redox (oxidació-reducció). Presenten propietats antioxidants, fet que ajuda a prevenir del dany cel•lular davant els radicals lliures. Aquests radicals són productes derivats del metabolisme i s’ha vist que en humans contribueixen al desenvolupament de patologies com el càncer o malalties coronàries. A més, col•laboren en la regulació de la funció tiroidea i tenen un paper destacat en el sistema immunitari.
Als organismes eucariotes, actuen com a enzims que participen en la homeostasis redox i en la defensa davant l’estrès oxidatiu, fet que repercuteix directament sobre la salut dels organismes que els sintetitzen.
Pel que fa als eucariotes unicel•lulars, els anomenats protistes, la distribució de selenoproteïnes és més diversa i desconeguda degut en gran part a la gran diversitat taxonòmica d’aquest grup d’organismes així com a la gran distància filogenètica que els separa. És per això que han estat estudiats i analitzats en el nostre projecte.
La dificultat en la cerca de selenoproteïnes rau en el fet que contenen selenocisteïna (SeC o U), el 21è aminoàcid, un anàleg de cisteïna (Cys) en el qual s’ha substituït l’àtom de sofre per un de seleni. La Sec ve codificada pel codó UGA que generalment constitueix un codó d’STOP. Tanmateix, en presència d’una estructura tridimensional en forma de loop, la SElenoCystein Insertion Sequence (SECIS), a l’extrem 3’ no traduït dels gens, la maquinària de traducció de selenoproteïnes és reclutada i s’evita la terminació. Per aquest motiu, l’anotació de les selenoproteïnes sol ser incorrecte i ha de ser corregida un cop trobades. [1] [2] [5] [6]

En la biosíntesi de les selenoproteïnes estan implicats un gran nombre d’elements.
Per a la síntesi de la selenocisteïna són necessaris:
- - SPS1: d’una banda s’ha vist que forma un complexe amb proteïnes involucrades en la biosíntesi de selenocisteïna, pel que es creu que probablement té un paper no essencial en el metabolisme de les selenoproteïnes (els knock downs no afecten la biosíntesi de selenoproteïnes i, a més, no es capaç de complementar la funció de Sps2). D’altra banda, es creu que podria tenir un paper en el reciclatge de selenocisteïna. En tot cas, la seva funció no implica la síntesi de selenofosfat.
- - SPS2: és un homòleg de la SelD (eubacteria) en mamífers i forma part de la maquinària de biosíntesi de les selenoproteïnes, concretament de la síntesi de selenocisteïna. D’una banda, estudis in vitro han demostrat que la Sps2 sintetitza selenofosfat a partir de seleni i que probablement està involucrada en la síntesi de novo. D’altra banda, estudis in vivo han demostrat que la Sps2 és essencial per generar el donant de seleni per la síntesi de selenocisteïna (knock downs de Sps2 tenen inhibida la biosíntesi de selenoproteïnes, que es recupera amb la transfecció de Sps2).
- - Secp43: reconeix motius de RNA gràcies a que té dos dominis d’unió a ribonucleoproteïna (RNPs). També forma un complex amb el tRNAsec i participa en la síntesi de selenocisteïna i en la regulació dels nivells d’expressió de tRNAsec metilat. A més, Secp43 té un paper estabilitzador del complex eEFsec-SBP2-tRNAsec.
En bacteris, el funcionament és diferent perquè no s'hi troba PSTK. La biosíntesi, doncs, no inclou aquesta fosforilació de la Serina per PSTK (perquè no hi és) i el substrat de SecS és directament seryl-tRNA. En conclusió, PSTK es troba en arquea i eucariotes i no es troba en bacteris, plantes i llevats. El fet que PSTK hagi estat altament conservat al llarg de la evolució suggereix que juga un paper important en la biosíntesi i/o regulació de selenoproteïnes.

I en la seva incorporació a la proteïna intervenen:
- - SBP2: és un factor que contribueix a la síntesi de selenocisteïnes. Recentment s’ha descobert que és part d’un complex de proteïnes implicat en la síntesi de selenocisteïnes i que participa en la incorporació dels factors eEFsec, SECp43, SPS1 i SLA. És una proteïna llarga, de 854 aminoàcids, on la regió N-terminal és essencial per a la funció d’incorporar selenocisteïnes.
- - eEFsec: la funció de eEFsec sembla que és complexa. Participa tant en la biosíntesi com en la incorporació de selenocisteïnes, i a més interacciona amb altres proteïnes i RNA de la maquinària de síntesi de selenoproteïnes. eEFsec interacciona amb les dues isoformes de la tRNAsec i amb SBP2. En el cas de tRNAsec, és necessari perquè SBP2 i eEFsec formin un complex tant al nucli com al citoplasma.
- - tRNAsec: regula la síntesi de totes les famílies de selenoproteïnes, ja que tradueix el codó UGA a selenocisteïna. La fosfoseryl-tRNAsec kinasa fosforila específicament la molècula seryl-tRNAsec en la síntesi de selenocisteïna. La majoria d’aquests elements són característics i exclusius dels organismes que contenen selenoproteïnes i poden ser utilitzats en la cerca d’aquestes proteïnes a través de diferents genomes.
[1] [2] [5] [6]
Tornar a dalt »
SelW
La SelW o Selenoprotein W és una selenoproteïna petita (85 a 88 aminoàcids) que fou identificada per primer cop en ovelles amb deficiència de Seleni. Els nivells més alts de SelW es troben en múscul, cor (excepte en roedors), melsa i cervell. S’ha obtingut la seva seqüència en rata i ratolí, mico, humà, ovella, porc, peix i pollastre. La seqüència de SelW és idèntica en rata i ratolí d’una banda, així com en mico i humà per altra banda.
En rates i micos s’ha observat glutationilació de SelW. La funció biològica de SelW no ha estat identificada completament, però hi ha evidències que indiquen que podria tenir funcions d’antioxidant, resposta davant estrès i implicació en immunitat cel•lular. La pèrdua d'aquesta selenoproteïna s'associa amb la malaltia del múscul blanc en ovelles. [3]
Tornar a dalt »
En rates i micos s’ha observat glutationilació de SelW. La funció biològica de SelW no ha estat identificada completament, però hi ha evidències que indiquen que podria tenir funcions d’antioxidant, resposta davant estrès i implicació en immunitat cel•lular. La pèrdua d'aquesta selenoproteïna s'associa amb la malaltia del múscul blanc en ovelles. [3]
Tornar a dalt »
MsrA
La MsrA o Metil sulfòxid reductasa A és una proteïna implicada en la protecció de les proteïnes cel•lulars davant d'estrés oxidatiu, fet que justifica la seva situació subcel•lular (tant a nivell citosòlic com nuclear).
En humans la localització d'aquest enzim és notòria en el sistema nerviós (SN) i ronyons, fet que ens ajuda a entendre la seva importància en el desenvolupament de malalties neurodegeneratives en models animals, per exemple. A més, també és expressat en el fetge, cèl•lules de la retina i cèl•lules del sistema immunitari com els macròfags. Recentment, s'ha descobert el paper de MsrA en la modulació de la kinasa calci/calmodulina II (CaMKII), que conté dos residus Met en tàndem que, en ser oxidats a Met-O, activen aquesta important molècula de senyalització.
S'ha estudiat la manca de MsrA en bacteris i llevats, que mostren una menor supervivència a la vegada que presenten gran quantitat de metionines oxidades acumulades. Altres evidències mostren que si aquest enzim és sobreexpressat en cèl•lules T humanes, les cèl•lules prolonguen la seva supervivència sota condicions estressants (oxidativament parlant).
La proteïna en estudi ha estat descrita en multitud d'organismes, des de mamífers (on va ser descoberta) fins a organismes més senzills com les Chlamydomones. Estudis diferencials entre les MsrA amb una selenocisteïna i les seves homòlogues en cisteïna (com per exemple de ratolí) mostren que les primeres tenen una activitat major. És més, en substituir la cisteïna del segon per una selenocisteïna es va observar un increment en la seva activitat reductora. [4]
En humans la localització d'aquest enzim és notòria en el sistema nerviós (SN) i ronyons, fet que ens ajuda a entendre la seva importància en el desenvolupament de malalties neurodegeneratives en models animals, per exemple. A més, també és expressat en el fetge, cèl•lules de la retina i cèl•lules del sistema immunitari com els macròfags. Recentment, s'ha descobert el paper de MsrA en la modulació de la kinasa calci/calmodulina II (CaMKII), que conté dos residus Met en tàndem que, en ser oxidats a Met-O, activen aquesta important molècula de senyalització.
S'ha estudiat la manca de MsrA en bacteris i llevats, que mostren una menor supervivència a la vegada que presenten gran quantitat de metionines oxidades acumulades. Altres evidències mostren que si aquest enzim és sobreexpressat en cèl•lules T humanes, les cèl•lules prolonguen la seva supervivència sota condicions estressants (oxidativament parlant).
La proteïna en estudi ha estat descrita en multitud d'organismes, des de mamífers (on va ser descoberta) fins a organismes més senzills com les Chlamydomones. Estudis diferencials entre les MsrA amb una selenocisteïna i les seves homòlogues en cisteïna (com per exemple de ratolí) mostren que les primeres tenen una activitat major. És més, en substituir la cisteïna del segon per una selenocisteïna es va observar un increment en la seva activitat reductora. [4]
Tornar a dalt »
Protistes
Els protistes conformen un regne extraordinàriament divers. Històricament, els organismes unicel•lulars que componen aquest regne havien estat agrupats segons la semblança aparent amb les cèl•lules de fongs, plantes o animals. Avui dia, s’ha vist que aquestes semblances són majoritàriament superficials i que no reflexen una història evolutiva compartida amb membres dels demés regnes eucariòtics. L’antiga taxonomia ha estat substituïda per classificacions basades en la filogènia. Tanmateix, encara resulten útils com a noms informals per descriure la morfologia i ecologia dels protistes.
Els protistes que nosaltres hem analitzat es poden veure explicats clicant aquí.

Els protistes que nosaltres hem analitzat es poden veure explicats clicant aquí.
Tornar a dalt »