El seleni
El seleni (Se) és un element nutricional essencial per la salut d'un ampli ventall d'espècies. Va ser descobert l'any 1817 per un químic suís, que el va denominar amb aquest nom recordant a la deessa grega de la lluna.
Es tracta d'un micronutrient poc abundant en la natura però de vital importància biològica per la seva implicació en processos cel·lulars antioxidants, en el metabolisme tiroideu i pel sistema immunitari. A més, s'ha pogut establir que tant un dèficit com un excés de seleni té repercussions en la salut. Un estat de carència es correlaciona, per exemple, amb la malaltia de Keshan, caracteritzada per una disfunció cardíaca. En canvi, la suplementació de seleni s'ha pogut relacionar amb la prevenció d'alguns processos tumorals.
El rol del seleni a l'organisme s'atribueix principalment a la seva associació amb una família de proteïnes. Forma part de l'aminoàcid selenocisteïna, considerat l'aminoàcid 21, que es designa amb la lletra U i es codifica amb el codó UGA (codó Stop). Les proteïnes que contenen selenocisteïnes (Sec) a la seva seqüència es coneixen com a selenoproteïnes. Aquest mecanisme de incorpoació evita la toxicitat del seleni ja que passa a trobar-se dins les selenoproteïnes i no de forma lliure per la cèl·lula.
Ha estat possible identificar selenoproteïnes als tres dominis de la vida, és a dir, en eucariotes, procariotes i archaea. Ara bé, no s'ha pogut identificar aquest tipus de proteïnes en llevats i plantes ja que en lloc de selenocisteïnesn contenen un residu de cisteïna.
La selenocisteïna
La selenocisteïna és un aminoàcid idèntic a la cisteïna amb la única diferència que el radical amb sofre (HS) és substituït per una molècula seleni (HSe).
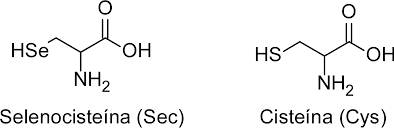
Figura 1. Comparació entre cisteïna i selenocisteïna
El selenio, un elemento poco conocido con un rol biológico importante
El sofre i el seleni es troben a la mateixa columna de la taula periòdica, per això se'ls hi confereix propietats químiques similars. Tot i així, l'àtom de seleni situat al centre catalític presenta major reactivitat que el grup sulfur. Aquest fet explica com en múltiples ocasions es troben homòlegs (ortòlegs o paràegs) de selenoproteïnes que contenen cisteïna en lloc de selenocisteïnes.
Síntesi de selenoproteïnes
El codó UGA, que normalment dóna lloc a una senyal de Stop o terminació de la traducció, també codifica per l'aminoàcid selenocisteïna. En aquest cas, a la cèl·lula s'ha produït una recodificació del codó induïda per l'element SECIS (selenocystein insertion sequence).
Per tant, per l'incorporació de la selenocisteïna a les selenoproteïnes cal un codó UGA seguit de l'element SECIS. Aquest, és una estructura tridimensional d'ARN en forma de loop que permet el reclutament de la maquinària de traducció i evita que es codifiqui pel codó STOP. Es troba localitzada al extrem 3'-UTR del gen de la selenoproteïna en eucariotes o downstream del codó UGA en procariotes.
Aquest procediment comença amb l'element SECIS que recluta una proteïna anomenada SECIS Binding Protein (SBP2), la qual permet la unió del factor d'elongació específic de selenoproteïnes (eEFSec). Aquest, atrau el selenocisteinil-tRNA (complementari al codó UGA) i determina la seva traducció a selenocisteïna. Així, es pot continuar la traducció fins que el ribosoma reconeix un nou codó de terminació.
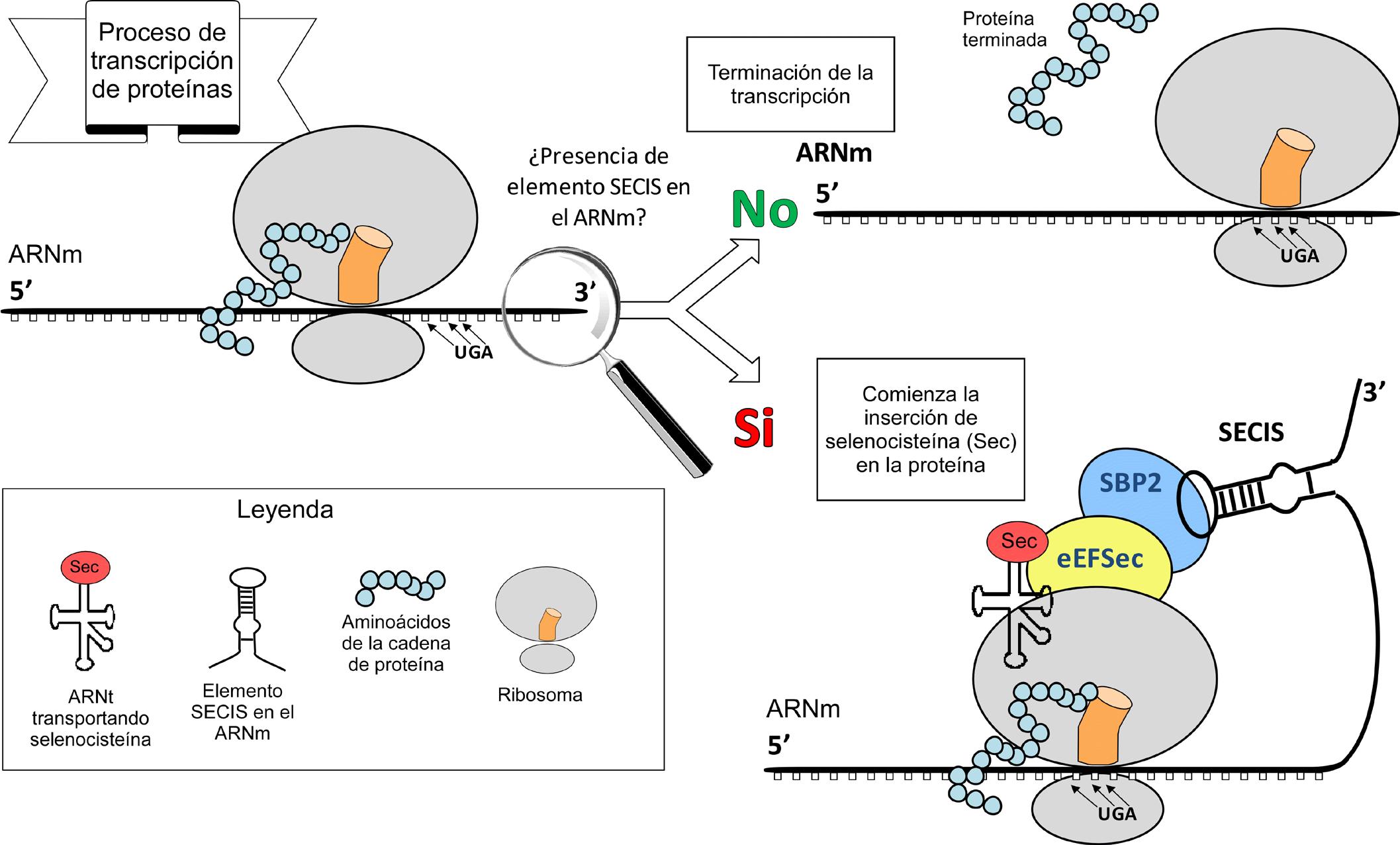
Figura 2. Procés de síntesi de selenoproteïnes
El selenio, un elemento poco conocido con un rol biológico importante
Evolució de les selenoproteïnes
Les selenoproteïnes es troben àmpliament exteses en els vertebrats. L’any 2012 es va reportar que el proteoma ancestral dels vertebrats tindria 28 proteïnes. Al llarg de l’evolució de les espècies, aquests proteomes haurien evolucionat per fenòmens de duplicació gènica, pèrdua de gens o conversió de la selenocisteïna a cisteïna, ocasionant que actualment no tots els mamífers ni vertebrats en general tinguin les mateixes selenoproteïnes en el seu genoma.
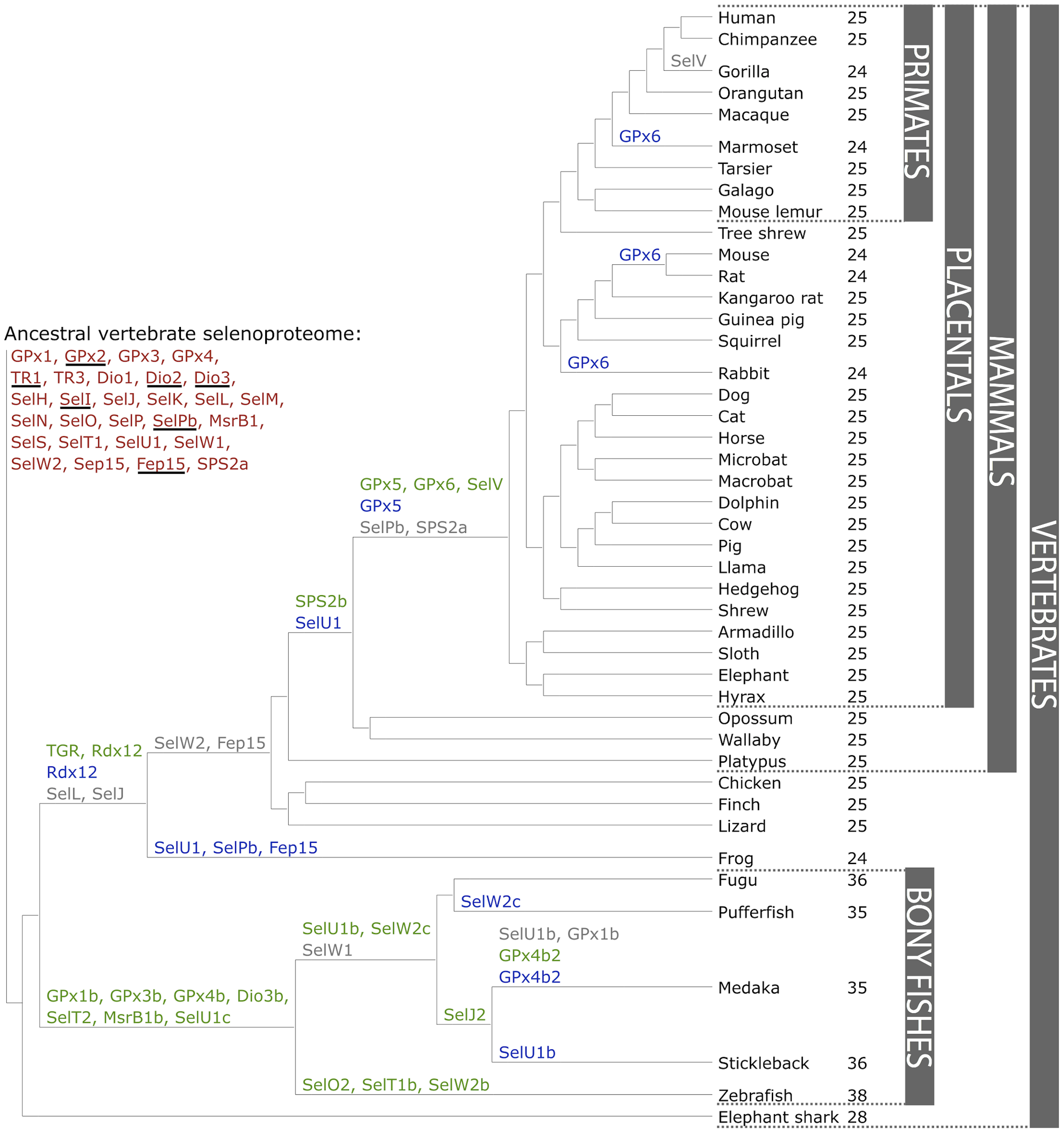
Figura 3. Evolució del selenoproteoma dels vertebrats. En vermell s’indica el selenoproteoma ancestral; en verd es mostren les duplicacions de selenoproteïnes; en gris les pèrdues i en blau les substitucions de selenocisteïna a cisteïna. Al costat del nom de cada espècie trobem el nombre de selenoproteïnes trobades
Composition and Evolution of the Vertebrate and Mammalian Selenoproteomes
Funcions de les selenoproteïnes
| Selenoproteïna | Funció | Localització |
DI1 |
Síntesi de l'hormona tiroidea T3 |
Membrana |
DI2 |
Síntesi de l'hormona tiroidea T3 |
Membrana |
DI3 |
Inactivació de l'hormona tiroidea T3 |
Membrana |
GPx1 |
Protecció contra l'estrès oxidatiu |
Citoplasma |
GPx2 (gastrointestinal) |
Protecció contra l'estrès oxidatiu |
Citoplasma |
GPx3 (secretada) |
Constitueix el 20% del seleni que es troba al plasma |
Secretada |
GPx4 |
Reducció dels fosfol&iaucte;pids i compostos derivats del colesterol |
Citoplasma/Mitocòndria |
GPx6 |
No caracteritzada (antioxidant) |
Citoplasma |
Sel 15/Sel M (homòlegs llunyans) |
Activitat antioxidant/modula el correcte plegament de pèptids |
RE |
Sel H |
Activitat redox |
Nucli |
Sel I |
Biosíntesis dels fosfolípids de la majoria de teixits |
Transmembrana |
Sel K |
Involucrada en el procés de degradació de proteïnes glicosilades associades al reticle endoplasmàtic (ERAD) |
Transmembrana RE |
Sel N (similar a Sel K i Sel S) |
Mutacions en gen de la Sel N (SEPN1) causen l’aparició de desordres musculars coneguts amb el nom de miopaties de tipus SEPN1 |
Transmembrana RE |
Sel O |
No caracteritzada |
- |
Sel P |
Múltiples residus de selenocisteïna. Transportar Se |
Secretada/Citoplasma |
Sel R |
Reparar proteïnes que han estat inactivades per l’oxidació de metionines |
Citoplasma |
Sel S |
Eliminació de proteïnes mal plegades del lumen del RE, protegir les cèl·lules del dany oxidatiu i l’apoptosi induïda pel estrès del RE |
Transmembrana RE |
Sel T |
Plegament de tipus thioredoxin-like (TRX) i un motiu molt conservat -Cys-x-x-Sec- com Sel W, Sel H i Sel V |
RE |
Sel V |
No caracteritzada. Ha evolucionat per duplicació de Sel W |
- |
Sel W |
Activitat redox |
Citoplasma |
SPS2 |
Síntesi de selenoproteïnes |
Citoplasma |
TR |
Activitat oxidoreductasa (antioxidant) |
TR1 (citoplasma/nucli) TR2 (mitocòndria) |
