Introducció
Introducció a les selenoproteïnes
Què són?
Les selenoproteïnes són un conjunt de proteïnes que es caracteritzen per contenir en la seva seqüència l'aminoàcid selenocisteïna (Sec) com un dels seus residus constituents. La selenocisteïna és l'aminoàcid número 21 en el codi genètic i és un anàleg de l'aminoàcid cisteïna (Cys) on un àtom de seleni (SeH) hi substitueix l'àtom de sofre (SH). El seleni i el sofre pertanyen al mateix grup en la taula periòdica, fet que els hi confereix propietats similars.El fet que el pKa de la selenocisteïna és menor que el de la cisteïna (5.2 i 8.3 respectivament) li proporciona una major reactivitat i millor eficiència catalítica a les selenoproteïnes.[1]
El codó UGA (stop) juntament amb un element d'inserció de selenocisteïna a la seqüència (SECIS), una estructura secundària de RNA, codifica per a una selenocisteïna enlloc d'acabar la síntesi de proteïnes. Les selenoproteïnes es troben distribuïdes en els tres dominis de la vida: Bacteris, Archeae i Eucariotes, tot i així, en eucariotes són més comunes. El nombre de selenoproteïnes en les diferents espècies varia molt segons el taxó. Per exemple, s'han determinat 3 selenoproteïnes en Drosophila melanogaster, 25 en humans i unes 30 en peixos. Tanmateix, no tots els organismes presenten selenoproteïnes, de moment en plantes no se n'ha trobat cap. A més a més, en alguns casos l'ortòleg d'una selenoproteïna té una cisteïna enlloc d'una selenocisteïna.[2]
Principalment, les selenoproteïnes actuen provocant reaccions redox on la selenocisteïna forma part de la regió catalítica i és essencial per la seva acció. També tenen altres funcions biològiques com: acció antioxidant, senyalització redox, metabolisme d'hormones tiroidees i participació en resposta immunitària.[1]
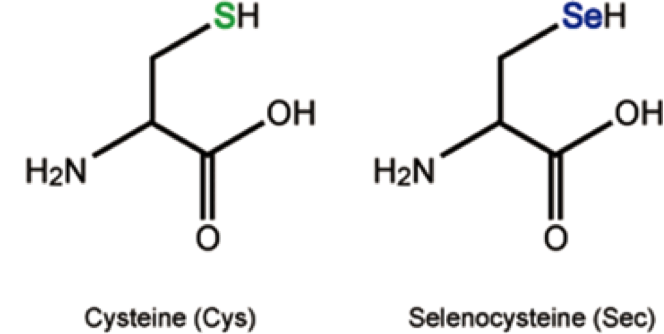
Figura 1: Estructura de l'aminoàcid cisteïna i selenocisteïna.
![]()
La importància del seleni
El seleni és un element poc abundant i constitueix un micronutrient essencial per animals, microorganismes i altres eucariotes. La manca de seleni pot arribar a provocar diferents alteracions com per exemple, la malaltia de Keshan. L'origen del nom prové de la província xinesa de Kesh, la qual tenia nivells baixos de seleni. El símptoma principal d'aquesta malaltia és la necrosi miocàrdica i pot arribar a portar a un debilitament del cor. D'altra banda, un excés de seleni pot conduir a intoxicacions greus (selenosi).[3][4][5]
A més a més, el seleni ha demostrat ser un agent quimioprotector contra el càncer bastant prometedor. També ha demostrat tenir un paper important en la reducció de l'expressió viral, en la prevenció de problemes cardiovasculars i cardíacs i en trastorns musculars.[3][4][5]
La funció del seleni en les selenoproteïnes és d'agent redox. A més a més, el seleni té altres funcions com la reducció dels peròxids d'hidrogen i hiperòxids de lípids i fosfolípids a productes inòculs com l'aigua i els alcohols.[3][4][5]
![]()
Síntesi
Síntesi de les Selenoproteïnes
La síntesi de selenoproteïnes està altament conservada en diferents espècies d'eucariotes, com també en procariotes i archaea.
La característica que tenen tots en comú és el codó UGA, un tRNA específic, els elements SECIS, i diversos factors reguladors.[3]
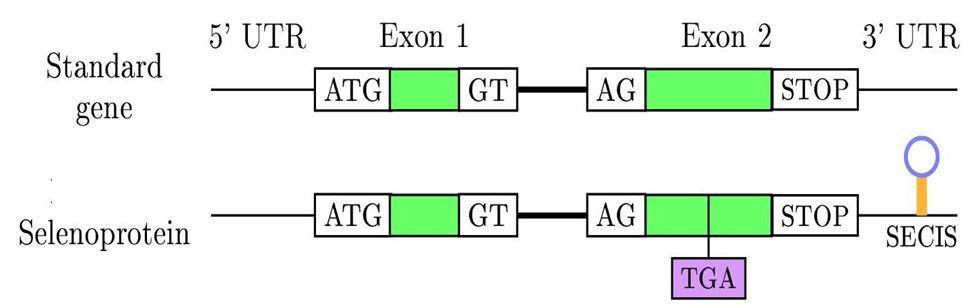
Figura 2: Codó UGA i element SECIS.
El codi genètic és redundant, els STOP codons (codons de terminació) estan codificats pels nucleòtids UAG, UAA i UGA. Tot i així aquests codons poden codificar per altres aminoàcids; en el genoma mitocondrial podem trobar que el codó UGA codifica per triptofan i en el genoma nuclear UGA pot codificar per una selenocisteïna, l'aminoàcid 21.[3]
GPx1 va ser la primera selenoproteïna descrita; es va veure que contenia una UGA en el seu marc de lectura obert. Poc després es va demostrar que la selenocisteïna s'incorpora amb un tRNA específic amb una seqüència complementària al codó UGA. Aquest tRNA controla l'expressió de totes les famílies de selenoproteïnes. Per poder sintetitzar el tRNA, hi ha d'haver un tRNA intermedi amb una serina.[3]
És important recordar que per a la síntesi de la selenocisteïna necesitem l'enzim SPS2, que també és una selenocisteïna; tot i que podem trobar organismes on s'ha substituit aquesta selenocisteïna per un homòleg de cisteïna. La seva funció és generar un donador de seleni, el monoselenifosfat.[3]
![]()
Síntesi de les Selenocisteïnes
La síntesi de les selenocisteïnes no és igual que la de la resta d'aminoàcids. El primer pas per a dur a terme la síntesi és l'addició d'una serina al tRNASec específic gràcies a la seryl-tRNA sintetasa i la foforil-tRNA kinasa s'encarrega de fosforilar la serina. Per passar a selenocisteïna es pot fer de dues maneres; a partir de la serina fosforilada o sense fosforilar. En qualsevol dels 2 casos s'activa la selenofosfat sintetasa SPS2 i forma el monoselenifosfat a partir del SeO32-. A continuació transformem la Ser-tRNASec a Sec-tRNASec per una selenocistein sintetasa que utilitza el monoselenophosfat com a substrat. L'activitat d'aquesta sintetasa pot estar donada pel complex SLA/LP per si sol o amb el complex SLA/LP-SECp43-SPS1. Finalment el factor d'elongació EFsec s'uneix al tRNASec, pot unir-s'hi sol o amb el complex SLA/LP-SECp43-SPS1.[6]
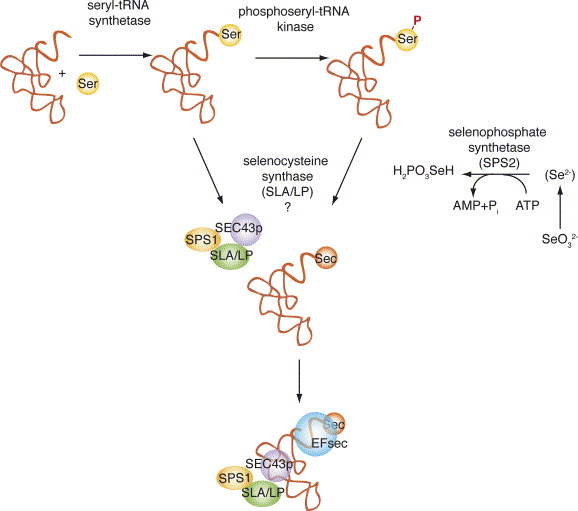
Figura 3: Síntesi de les selenocisteïnes.
![]()
Anotació i predicció
La indentificació computacional de les selenoproteïnes és complicada degut a que les selenocisteïnes són codificades pel codó UGA que de manera sistemàtica es considera un codó STOP; fent difícil la identificació d'aquestes proteïnes a través d'un programa automàtic.Per aquest motiu, no existeix un mètode exacte per a predir la localització de selenoproteïnes al genoma. [7]
Per tal de predir els gens on es troben les selenoproteïnes en un genoma que no s'ha analitzat prèviament, primerament s'han de buscar seqüències de selenoproteïnes conegudes (per exemple, selenoproteïnes anotades al genoma humà o un genoma filogènicament proper al d'interès) al genoma nou. Un altre element per tal de poder fer una correcta cerca d'aquestes selenoproteïnes és la cerca d'elements SECIS a la regió 3'UTR del gen candidat. Això et permet reconèixer aquesta pauta de lectura alternativa del codó UGA. Aquesta aproximació però, té un problema: la poca conservació que hi ha a nivell de seqüència els elements SECIS entre les diferents espècies i les diferents selenoproteïnes.[7]
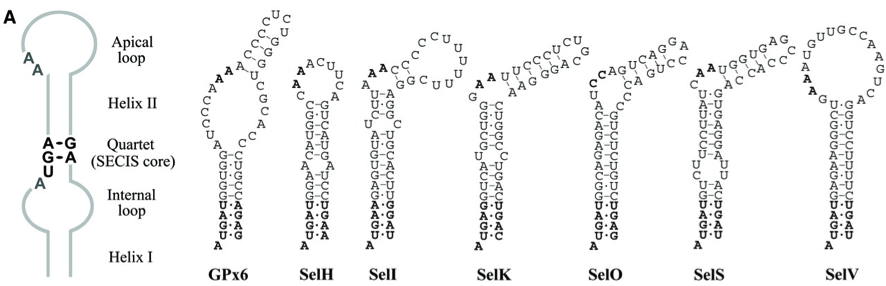
Figura 4: Diferents estructures de SECIS per a diferents selenoproteïnes humanes.
És a dir, d'una seqüència de 100 nucleòtids només es conserven dues A en la posició del loop i unes 5 posicions en l'hèlix II entre les selenoproteïnes humanes. Això dificulta molt la identificació d'aquestes estructures. Tot i que no hi hagi cap conservació a nivell de seqüència entre els SECIS, tenen una estructura tridimensional loop-helix-loop característica que permet la indentificació dels SECIS mitjançant programes bioinformàtics com SECISEARCH3.0/Seblastian.[7]
Per tant, un bon procediment per tal de predir selenoproteïnes en un genoma que encara no ha estat analitzat és:
en primer lloc, buscar seqüències de selenoproteïnes ja anotades en espècies properes (proteïnes homòlogues). Després cercar elements SECIS a l'extrem 3'UTR mitjançant eines bioinformàtiques. Fent servir les dues dades, obtindrem els gens candidats.[7]
![]()
Lethenteron camtschaticum
Descripció
Lethenteron camtschaticum, també coneguda com a llamprea àrtica deu el seu nom al Grec; letheia significa apàtic i enteron significa intestí.[8]
Té una mida entre 13 – 32cm de llargada, però s'han descrit espècimens que poden arribar fins als 63cm. Els individus no anàdroms en canvi, no passen dels 18cm. Però els mascles són sempre més grans que les femelles. El color pot variar entre el marró, gris o color verd oliva amb el ventre més clar. Té dues aletes dorsals situades al costat de la cua; la que està més posterior és més gran que la que està en posició anterior. [8]
És un peix sense mandíbula i el seu hàbitat és tant l'aigua dolça com l'oceà. És un animal anàdroms; de la mateixa manera com ho fa el salmó, migra de l'oceà als rius. És la llamprea més comuna de la regió àrtica; la trobem a la costa Siberiana i el riu Anderson a Canadà. També la trobem al Nordoest del Pacífic, des del sud del mar Bering fins al Japó i Korea. Hi ha algunes espècies que viuen exclusivament en aigua dolça, les trobem als rius Slave, Hay, Mackenzie (territoris del nord de Canadà) i Mongòlia. A Europa la podem trobar als mars Russos i Noruegs. És una espècie en perill d'extinció local degut a la pol·lució i al seu ús com a esquer. [8]
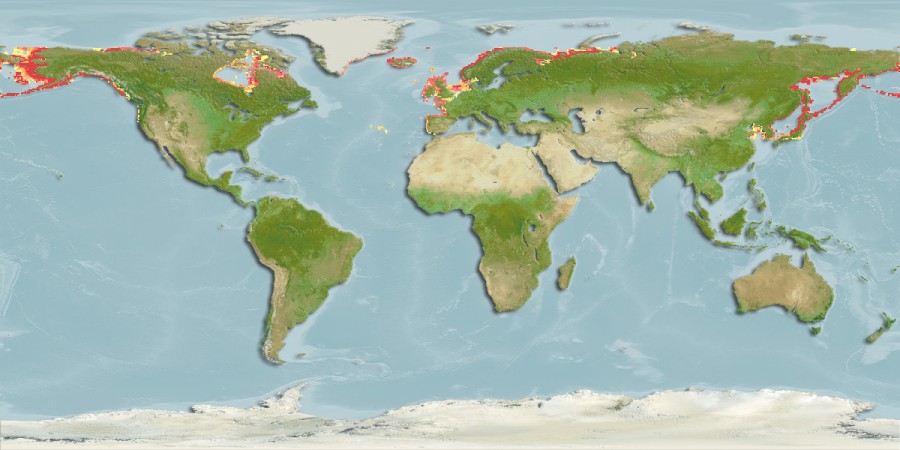
Figura 5: Mapa on es representa l'hàbitat
Els adults van a desovar a la grava i a la llera de rius. Les larves de la llamprea es troben a aigua dolça fangosa, on s'enterren i s'alimenten de petites partícules de matèria orgànica. Els individus adults són generalment uns paràsits que s'enganxen a qualsevol altre espècia de peix. Les no migratòries, és a dir, que viuen permanentment en aigua dolça, no són paràsits. Els juvenils s'alimenten d'invertebrats aquàtics, algunes algues i partícules de matèria orgànica.[8]
![]()
Taxonomia
Regne: Animalia
Filum: Chordata
Subfilum: Vertebrata
Superclasse: Agnatha
Classe: Cephalaspidomorphi
Ordre: Petromyzontiformes
Família: Petromyzontidae
Subfamília: Lampetrinae
Gènere: Lethenteron
Espècie: Lethenteron camtschaticum [9]

Figura 6: Llamprea adulta
Aquesta espècie té altres sinònims com:
Lampetra camtschatica
Lampetra japonica
Lampetra japonica
Lethenteron japonicum [9]
![]()
Filogenètica
Per poder trobar les selenoproteïnes presents en Lethenteron camtschaticum hem comparat el seu genoma amb el de Petromyzon marinus.
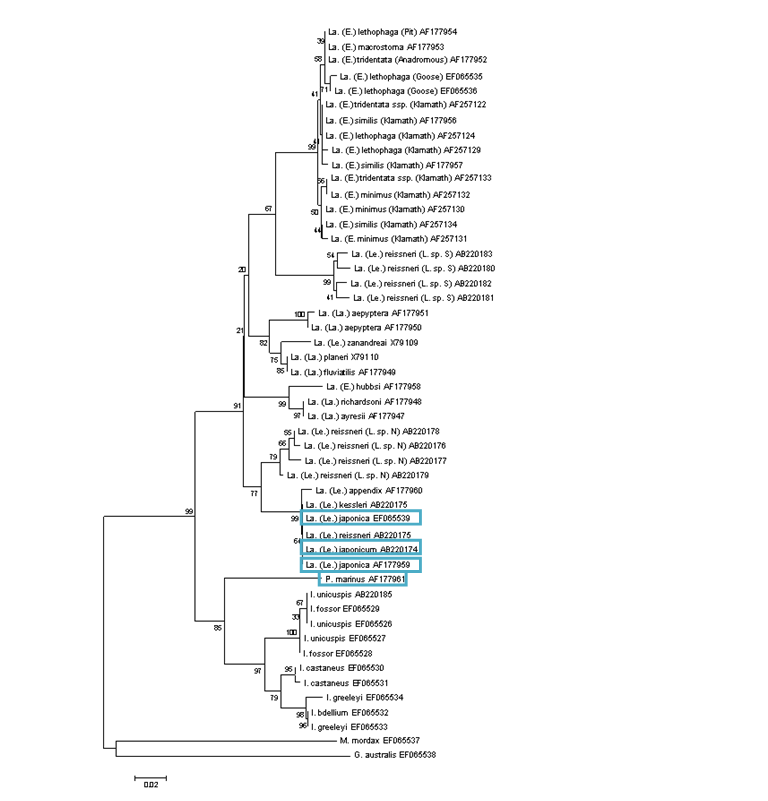
Figura 7: Filogenètica on veiem la nostra espècie (amb els seus sinònims) i l'espècie amb què la compararem
Hem triat aquesta espècie per dos motius: les selenoproteïnes estaven anotades en la base de dades SelenoDB i és una espècie relativament a prop filogenèticament. Quan el genoma de Petromyzon marinus no estava ben anotat, hem hagut de fer servir com a model el de Homo sapiens, que també estaven disponibles a SelenoDB.
![]()
