TblastN
En el TblastN de la selenoproteïna humana SelR1 s'obtenen diferents hits però tots ells amb un e-value alt, i en cap d'ells l'alineament arriba fins a la selenocisteïna.
Per veure l'alineament clica aquí
Clica la imatge per veure-la gran
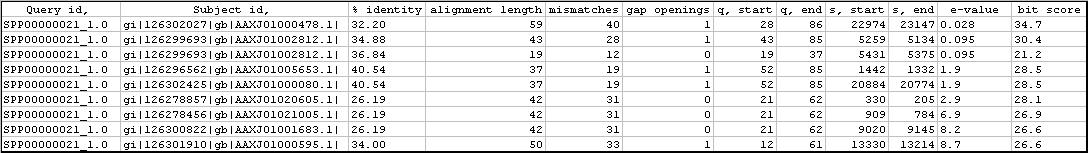
En el TblastN de les proteïnes humanes SelR2 i SelR3, que són homòlogues en cisteïna, sí que s'obtenen bons hits. Totes dues proteïnes alineen amb la mateixa regió del genoma de P.marinus amb un e-value similar. És per això que es suposa que tot i que en humans hi ha tres SelR, en P.marinus només hi ha una.
Per veure l'alineament clica aquí

Clica la imatge per veure-la gran
En l'alineament es veu que la possible proteïna de P.marinus alinea també una cisteïna amb homòloga humana.
Predicció de SelR en P. marinus
Per tal d'obtenir la seqüència proteica de la possible proteïna i el seu cDNA, s'utilitza el programa Genewise. El qual prediu una seqüència peptídica molt curta però que conté la cisteïna.

Clica la imatge per veure-la gran
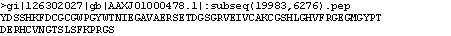
Clica la imatge per veure-la gran
Per veure el fitxer Genewise clica aquí
Blastcl3 nr El resultat del blastcl3 per la selR predita es pot veure aquí