

 |  |  |  |  |  |  |
| INTRODUCCIÓN | OBJETIVOS | MATERIALES | RESULTADOS | DISCUSIÓN | AGRADECIMIENTOS | REFERENCIAS |

Descubierto en el año 1817 por Berzelius, el selenio originalmente y durante mucho tiempo fué considerado un elemento tóxico. No fué hasta mediados de los años 50 cuando su relevancia fisiológica fué evaluada correctamente1. Hoy en día cada vez hay mayores evidencias que relacionan el selenio con funciones como la prevención del cáncer, el sistema inmunitario, la fertilidad masculina, enfermedades tanto cardiácas como musculares y prevención y control del proceso de envejecimiento2.
Se cree que la mayoría de los efectos biomédicos del selenio está mediados por las selenoproteínas, por lo tanto la identificación y caracterización de las selenoproteínas eucarióticas son esenciales para entender el papel que juega el selenio en la salud3. A pesar de los beneficios potenicales del selenio para la salud, los mecanismos por los cuales los ejercería están aún por descubrir.
Se han identificado selenoproteínas en los tres dominios de la vida (Eukarya, Archaea y Prokarya) aunque tienen una distribución irregular. No existen selenoproteínas ni en plantas superiores ni en levaduras. En procariotas y arqueobacterias, estas selenoproteínas han sido identificadas en un pequeño número de especies. Apenas hay correspondencia entre los selenoproteomas de procariotas y eucariotas.4 Hasta el momento se conoce la existencia de 25 selenoproteínas en eucariotas pero la distribución taxonómica varía considerablemente. Muchas de las funciones de estas selenoproteínas son desconocidas (tabla 1) y aquellas de las que se conoce la función mayoritariamente son oxidoreductasas implicadas en multiples vías metabólicas, p.e., neutralización de radicales libres, mantenimiento del status redox intracelular, regeneración de lípidos oxidados o metioninas. Otras selenoproteínas están involucradas en el metabolismo de la hormona tiroidea, síntesis de selenocisteína o en algunas de las diferentes fases de la maduración del esperma. En todos estos casos se ha visto que la selenocisteína forma parte del centro activo de las enzimas. Esta selenocisteina actúa como homóloga de la cisteína pero presenta mayor reactividad conferida por la ionización del grupo selenol a pH fisiológico1.
Fig.1. Selenocisteína y cisteína
El selenio está presente en las selenoproteínas en forma de selenocisteína (Sec), el vigesimoprimer aminoácido. La Sec es insertada durante la traducción en respuesta al codón UGA, codón de terminación en el código genético universal. La traducción del triplete UGA como codón stop o Sec depende de diversos factores cis y trans . En eucariotas el principal factor cis es un elemento del mRNA, la secuencia de inserción de selenocisteína (SECIS) localizado en la región 3' UTR3. La región SECIS se caracteriza por que contiene un motivo AUGA conservado, 9-12 nucleótidos upstream de la región conservada AAA/G(AAR) que se localiza en la terminal del loop.
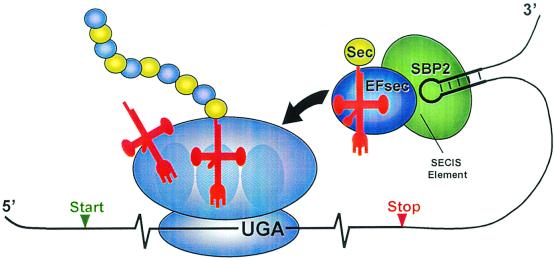
Fig.1.Mecanismo de inserción de Sec en eucariotas. El selenocysteil-tRNA(rojo con Sec en amarillo) se muestra en un complejo con EFsec (factor de elongación específico de Sec, azul) y SBP2 (SECIS binding protein 2, verde) y el elemento SECIS (mostrado como una horquilla en negro). El complejo está listo para la donación de selenocysteil-tRNA al sitio A del ribosoma para ser decodificado por UGA (mostrado en el mRNA en negro). Una vez la SectRNA[Ser]Sec es donada al sitio A, Sec tRNA[Ser]Sec es transeferido al sitio peptídico y Sec es incorporado al selenopeéptido que se está formando el cual aparece mostrado como bolas en azul y amarillo. El mRNA (mostrado en negro con sus codones de inico y final) está unido a la más pequeña de las dos subunidades del ribosoma y el tRNA no acetilado se muestra dejando al sitio de salida del ribosoma5