INTRODUCCIÓ
|
El seleni (Se) és un micronutrient amb un paper crucial pel manteniment de l’homeòstasi immune-endocrina, metabòlica, i cel·lular. És un component vital per moltes espècies, ja que una deficiència severa d’aquest nutrient pot causar diverses malalties, com per exemple, la malaltia de Keshan. Tot i així, un excés d’aquest micronutrient pot causar toxicitat (selenosis) aguda o crònica. És per això que aquest element no es troba mai en forma lliure, sinó conjugat en un grup de proteines, anomenades selenoproteïnes. [1] L’element Se duu a terme les seves funcions nutricionals en forma de selenocisteïna (Sec), l’aminoàcid 21, inserit dins les selenoproteïnes. La selenocisteïna és un anàleg de la cisteïna amb la substitució del radical sofre (SH) per un de seleni (Se). La Sec està codificada pel codó UGA, un dels tres codons STOP per la traducció de mRNA en la resta de gens. El reconeixement del codó UGA com a un lloc d’inserció de Sec en comptes d’una senyal de parada, requereix la presència d’un element SECIS (SelenoCysteine insertion sequence) en la regió 3’ UTR del mRNA de la selenoproteïna i un tRNA-selenocisteil únic. A diferència dels 20 aminoàcids estàndars, la Sec es biosintetitzada a partir de la serina en el seu tRNA. En el genoma humà trobem 25 selenoproteïnes codificades. La majoria d’aquestes van ser descobertes per aproximacions bioinformàtiques, buscant elements SECIS.[2] La Sec presenta una major capacitat nucleofílica i electrofílica que la cisteïna, i està present en el lloc catalític de tots els selenoenzims. La majoria de les selenoproteïnes, amb funció coneguda, estan involucrades en sistemes redox i en vies de senyalització. [2] 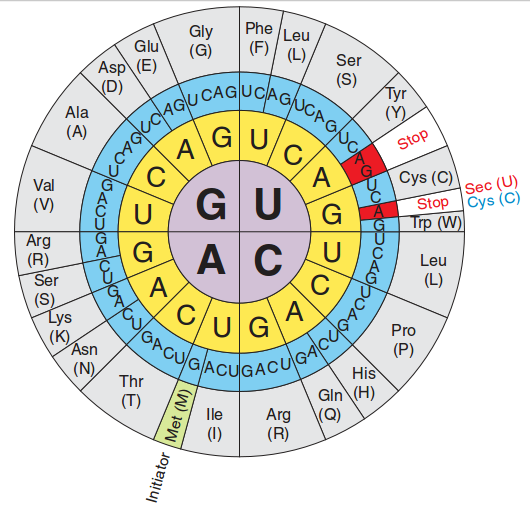 Figura 1. El codi genètic il·lustrant la funció dual del codó UGA i que la Sec és el aminoàcid 21 codificat per UGA. [4] El Se ingerit a través de la dieta ha de ser convertit a selenur (Se2-), que serveix com a donant per la incorporació del Se en les selenoproteïnes. Les formes inorgàniques del Se, com el selenit (SeO32-), són convertides a Se2- via glutaredoxines i tioredoxines, mentre que les formes orgàniques són metabolitzades a Se2- per la seleocisteïna liasa (Scly) o per trans-selenació. Després de la conversió del Se de la dieta a Se2-, es produeix una reacció catalitzada per la selenofosfat sintetasa 2 (SPS2) donant lloc a selenofosfat (SePo33-). La selenocisteïna (Sec) és incorporada a les proteïnes a través del seu tRNA únic (tRNA[Ser]Sec). El tRNA[Ser]Sec decodifica el codó UGA com a Sec en comptes d’un codó STOP, com és normal en altres aminoàcids, i així preveu la terminació prematura. [3]
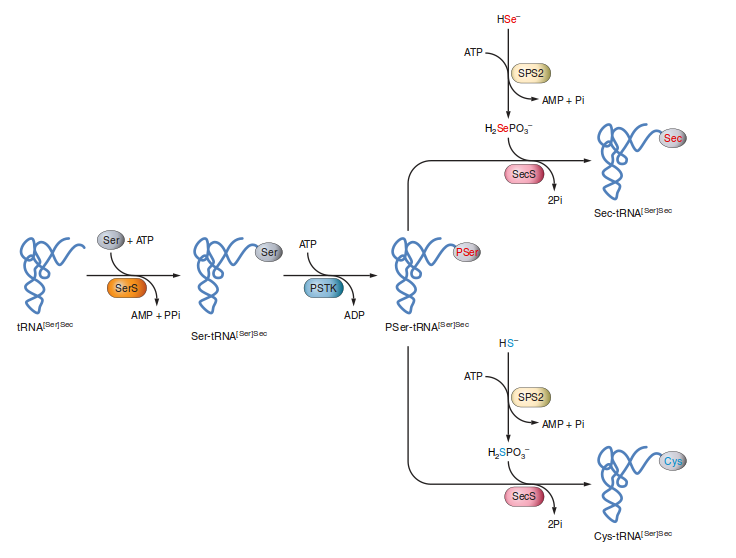 Figura 2. Mecanisme de biosíntesi de Sec i Cys en eucariotes. [4] Això és possible gràcies a la presència d’un element SECIS (Sec insertion sequence), una estructura específica cis amb forma de loop, en la regió 3’ UTR del mRNA de la selenoproteïna, que actua com a plataforma per proteïnes d’unió al RNA. L’element SECIS forma complexes amb dos elements trans: el factor d’elongació (eEFsec) i la proteïna d’unió a SECIS 2 (SBP2). El factor EFsec interactua amb SBP2 per tal de reclutar el tRNA[Ser]Sec i media la inserció de la Sec en la proteïna en resposta a un codó UGA. Dins els tres dominis de SBP2, el domini d’incorporació de Sec i el domini d’unió a RNA (terminal COOH-) estan involucrats específicament en la unió de SECIS. També s’han identificat altres proteïnes d’unió SECIS, com la proteïna ribosomal L30 (RPL30), que és part de la maquinària d’inserció basal de Sec i té un domini d’unió a RNA similiar al de SBP2. [3] 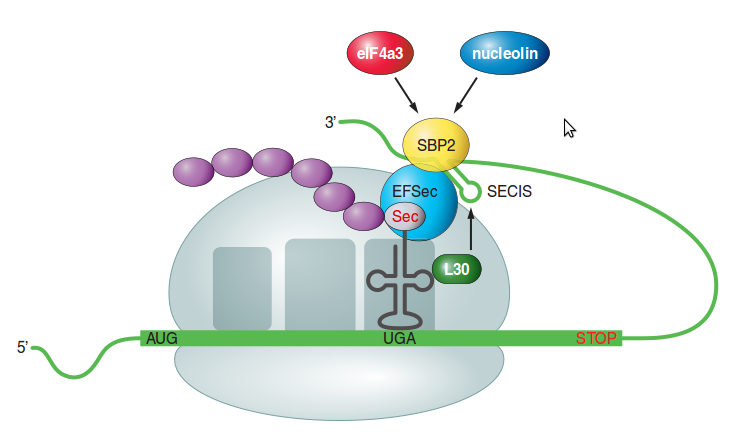 Figura 3. Mecanisme d'inserció de Sec en eucariotes. La figura mostra els factors coneguts que es requereixen per la incorporació de Sec en les selenoproteïnes en resposta al codó UGA. [4] 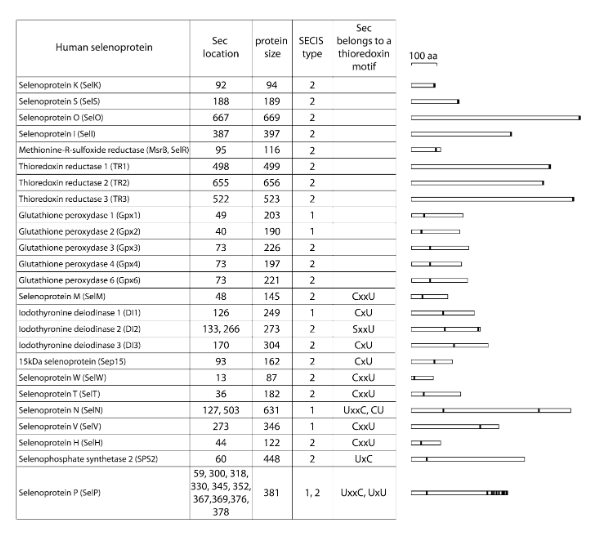 Figura 4. Selenoproteïnes presents en el genoma humà. Els tipus de SECIS i els residus Sec pertanyen als diferents motius de tioredoxina tal i com es mostra (C; cisteïna, x: qualsevol aminoàcid, U; residu Sec). A la dreta, es mostren les mides relatives de les diferents selenoproteïnes (relatiu a un aminoàcid d’escala 100). La localització del Sec dins de la proteïna es mostra amb la línia negra. Tal i com s’ha explicat anteriorment, una característica clau comuna en totes les selenoproteïnes és la presència de residus Sec en les seves seqüències. Amb molt poques excepcions, aquest aminoàcid es troba en el lloc catalític de tots els selenoenzims per tal de dur a terme reaccions redox catalítiques. Així doncs, les funcions fisiològiques de les selenoproteines depenen estrictament de la presència de Sec, i mutacions en aquest aminoàcid o altres pot derivar en una inactivació enzimàtica. El selenoproteoma humà es troba codificat per 25 gens. tot i que, totes les selenoproteïnes estan involucrades en sistemes redox, cadascuna juga un paper biològic diferent. Aquestes 25 selenoproteïnes son: Glutatió peroxidases (Gpx1, Gpx2, Gpx3, Gpx4, Gpx5, Gpx6, Gpx 7, Gpx8)
Hormones tiroidees deiodinases (DI1, DI2 i DI3) Tiorredoxina Reductases
Metionia-R-Sulfoxida Reductasa (MsrB1) 15kDa Selenoproteïna (Sel15) i Selenoproteïna M (SelM) Selenoproteïnes W, T, H i V
Selenofosfatasa sintetasa 2 (SPS2) Selenoproteïna P (SelP) Selenoproteïna O i I (SelO i SelI) Selenoproteïna S i Selenoproteïna K (SelS i SelK)
Selenoproteïna N (SelN)
El descobriment de les selenoproteïnes i el seu mecanisme de traducció associat és relativament recent. A més, la dualitat del codó UGA dificulta la identificació i l'anotació dels gens codificants per selenoproteïnes a partir d'un programa automàtic. Això va provocar en un passat, molts errors en l'anotació d'aquests gens, ja que moltes vegades s'identificava el codó UGA com un lloc de terminació de open reading frames (ORFs) en lloc de predir una determinada selenoproteïna. Una alternativa per poder identificar correctament aquestes proteïnes és a través de l'identificació i la cerca dels elements SECIS a la regió 3'UTR del gen candidat. Tot i que aquest mètode ha permès l'identificació de nombroses selenoproteïnes, presenta el problema de la poca conservació a nivell de seqüència entre diferents espècies. |
|
L’espècie Odobenus rosmarus, communment coneguda com a morsa, és un mamífer carnívor semiaquàtic que habita en mars àrtics. Dins d’aquesta espècie trobem tres subespècies; la morsa de l’Atlàntic (Odobenus rosmarus rosmarus), la del mar de Làptev (Odobenus rosmarus laptevi) i la morsa del Pacífic (Odobenus rosmarus divergens) en la que ens centrarem en el treball. Com bé indica el seu propi nom, aquesta subespècie habita en les aigües del pacífic. Les morses, amb les seves pells arrugades grises i rosades, es distingeixen pels seus llargs bigotis, aletes planes, cossos greixosos i sobretot pels seus llargs quiexals blancs. Aquests individus tenen la pell gruixuda, entre 2 i 4 cm de gruix. Un tret distintiu entre mascles i femelles són els grans nòduls que apareixen sovint en la pell dels mascles. Aquest nòduls aparèixen durant l'època de pubertat com a caràcters sexuals secundaris. El pelatge de la morsa canvia de color segons la temperatura; a l'aigua freda tenen un color gris clar mentre que a temperatures més càlides presenten cossos més rosats degut a la dilatació dels vasos sanguinis de la pell i l'increment de circulació associat. Les morses tenen pèl que recobreix tot el cos a excepció de les aletes. Tots dos gèneres muden el pèl durant l'any, però el mascle ho fa entre juny i agost mentre que les femelles poden trigar més temps a mudar-lo. Pel que fa a la mida, difereixen segons la subespècie. Les morses del Pacífic tenen una mida superior respecte les altres subespècies. Els mascles pesen al voltant de 1000kg arribant a pesar fins 1.800kg, tot i que la morsa del Pacífic més gran que s’ha arribat a descriure (actualment conservada al Museu de Horniman de Londres) va arribar a pesar 2.265kg i mesurar 9.14m de longitud. Pel que fa a la seva llargada, normalment mesuren al voltant d'uns 2-3 metres. Entre els individus de la subfamília dels pínnipedes, només alguns elefants marins superen la seva mida.
Les morses s’alimenten d’una gran varietat d’invertebrats tous que es troben sota el fons marí amb l’ajuda dels seus bigotis sensibles per buscar les preses. La seva alimentació es basa principalment en mol·luscs, cucs i cogombres de mar entre altres. Algunes d’elles, especialment mascles, són reconeguts per caçar foques i aus marines.
Les morses del pacífic viuen durant l’hivern a les zones gelades del mar de Bering abans de separar-se i migrar durant la primavera. És en aquesta estació, quan les femelles amb cries migren des del nord del Mar de Bering fins el Mar de Chukchi. La majoria de mascles prefereixen emigrar cap a les badies de Bristol. Cap a finals de la tardor, les morses tornen als seus llocs d’origen. 
En aquest treball s’ha comparat la seqüència de l'Odobenus rosmarus divergens amb dues espècies. Primerament, s’ha comparat amb les proteïnes homòlogues del Felis catus, ja que com podem observar en la figura es troba relativament aprop filogenèticament de la nostra espècie. Tot i així, també s’ha dut a terme l’anàlisi comparant-lo amb el genoma humà, ja que és el que està més ben anotat i estudiat.
|

