Introducció
Les selenoproteïnes han estat identificades en tots els tipus de vida: eucariotes, arqueobacteris i eubacteris. No obstant, no es troben en tots els organismes. Aquestes proteïnes és caracteritzen per contenir com a mínim una selenocisteïna (Sec). Sec és un aminoàcid molt semblant a la cisteïna que conté un àtom de seleni (Se) enlloc de sofre (S). Està codificat pel codó UGA, que és típicament un codó de terminació.
S’ha relacionat el dèficit de Se amb diferents condicions patològiques com són la malaltia cardíaca, trastorns neuromusculars, càncer, infertilitat masculina i inflamació. A més a més, s’ha observat que el Se està implicat també en el desenvolupament dels mamífers, en la funció immunitària, en la inhibició de l’expressió viral i en el retard de la progressió de la SIDA en pacients HIV-positius. S’ha suggerit que moltes selenoproteïnes són responsables dels beneficis del Se a la salut.
Torna a dalt
Torna a la Introducció
Biosíntesi de Sec
Sec tRNA
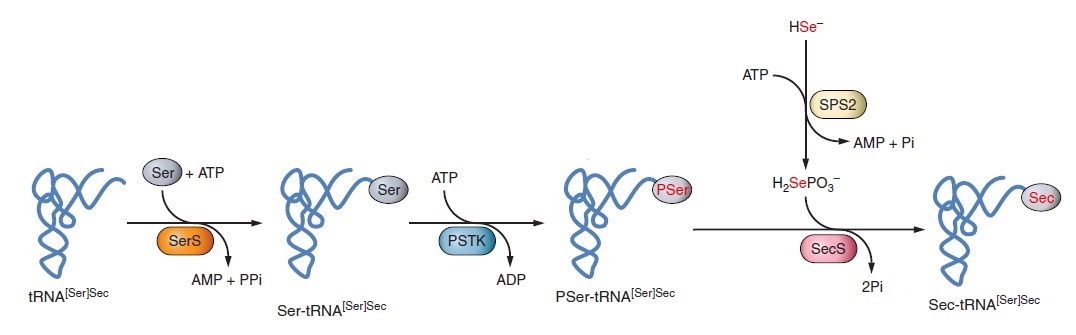
Sec és l’únic aminoàcid la biosíntesi del qual es produeix en el seu propi tRNA, anomenat Sec tRNA[Ser]Sec. El tRNA[Ser]Sec és inicialment aminoacilat amb serina en una reacció catalitzada per la seril- tRNA sintasa (SerRS) per formar seril- tRNA[Ser]Sec que proporciona l’esquelet per la biosíntesi de Sec.
El tRNA[Ser]Sec té una longitud de 90 nucleòtids a diferència de la resta que tenen una longitud aproximada de 75 nucleòtids. A més a més de ser més llarg, també presenta algunes bases modificades i un braç excepcionalment llarg. Presenta un grup trifosfat unit a la guanosina del seu extrem 5’. Això és degut a la seva transcripció inusual, la qual comença al primer nucleòtid de la seqüència codificant on tots els RNA canònics tenen una seqüència líder al 5’ que és processada posteriorment.
El gen que codifica per tRNA[Ser]Sec, Trsp, és de còpia única en tots els organismes que s’han examinat excepte el peix zebra que en conté dues. La regulació de la seva expressió és governada per 3 regions upstream: un motiu TATA box a -30 nucleòtids, un element de seqüència proximal a -70, i una element de seqüència distal a -200.
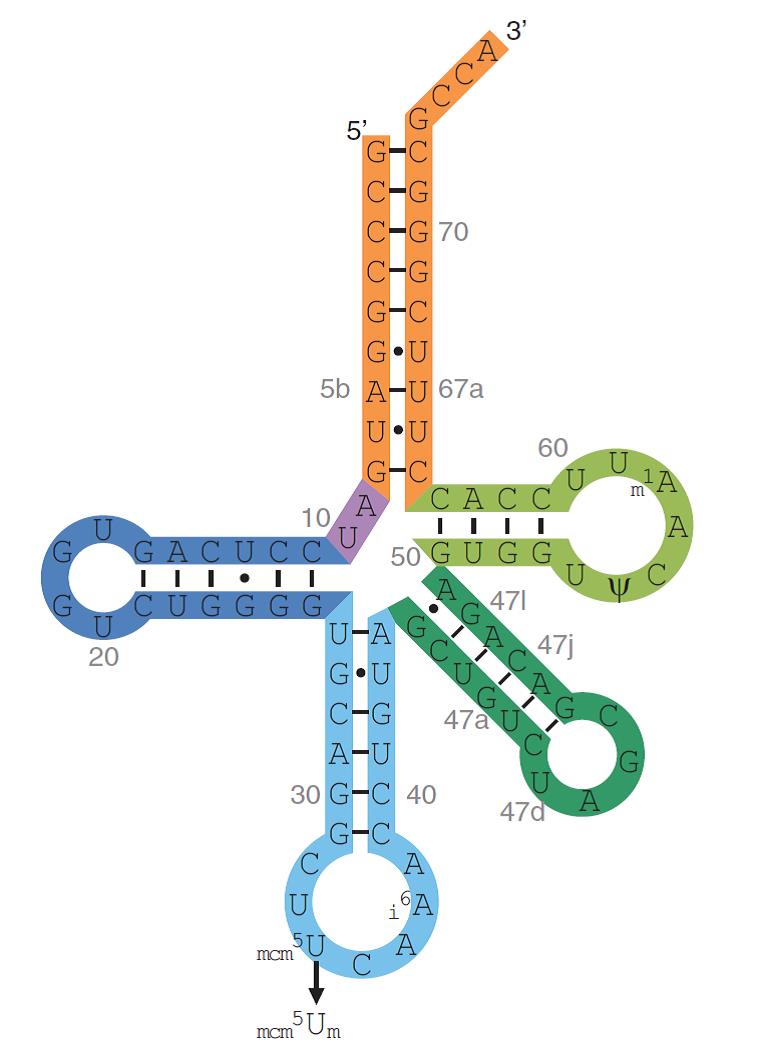
S’han identificat dues isoformes de tRNA[Ser]Sec i ambdues formen fosfoseril-tRNA[Ser]Sec. Ambdues presenten les següents modificacions de bases: 1-metiladenosina a la posició 58, pseudouridina a la posició 55 i isopenteniladenosina a la posició 37. El que diferencia ambdues isoformes és la modificació que presenten al nucleòtid 34 (al loop anticodó). La isoforma que conté 5-metoxicarbonilmetil (mcm5U) serveix com a precursora de la que conté 5-metoxicarbonilmetil-2’-O-metiluridina (mcm5Um). La metilació Um34 és l’últim pas de la maduració del tRNA[Ser]Sec ja que requereix la presència d’altres modificacions, una estructura intacta i l’aminoacilació del tRNA.
Per últim, cal detallar que la distribució relativa d’ambdues isoformes es troba influenciada per l’estatus de Se. Si l’individu presenta deficiència de Se, el nivell de mcm5U és major al de mcm5Um. En el cas de la suplementació amb Se passa el contrari. A més a més, s’ha observat que les selenoproteïnes housekeeping són sintetitzades mitjançant la isoforma mcm5U, mentre que les selenoproteïnes relacionades amb l’estrès són sintetitzades per la isoforma mcm5Um.
Seril-tRNA sintetasa
L’aminoacilació del tRNA[Ser]Sec amb Ser és el primer pas per la síntesi de Sec, ja que la porció Ser serveix d’esquelet per Sec. Aquest pas el du a terme la seril-tRNA sintetasa (SerS).
Fosfoseril-tRNA[Ser]Sec quinasa i Sec sintasa
La conversió de Ser en Sec és catalitzada per dues proteïnes. La fosfoseril-tRNA quinasa (PSTK) sintetitza l’intermediari O-fosfoseril-tRNA[Ser]Sec i, a continuació, la Sec sintasa (SecS) incorpora el selenofosfat en l’esquelet aminoacídic i forma Sec-tRNA.
Selenofosfat sintasa
El selenofosfat és la forma activa del seleni i es sintetitza a l’organisme gràcies a la SPS2. Aquesta és una selenoproteïna necessària per a la síntesi de novo de selenofosfat. Sembla que serveix també d’autoregulació de la síntesi de selenoproteïnes. A part d’aquestes funcions, en deficiència de Se, SPS2 és capaç d’utilitzar sulfur en lloc de selenur. D’aquesta manera pot sintetitzar Cys de novo utilitzant la maquinària Sec i inserir Cys a les selenoproteïnes en el lloc de Sec. Això ha sorprès ja que la cisteïna és un aminoàcid essencial en mamífers i la síntesi de Cys en el tRNA[Ser]Sec representa una via nova per la síntesi d’aquest aminoàcid. Per altra banda, trobem SPS1 que sembla tenir un paper en el reciclatge de Sec però no mostra capacitat de sintetitzar selenofosfat de novo.
Sec liasa
La Sec liasa (SCL) és la proteïna encarregada de descompondre aquest aminoàcid. Catalitza la degradació depenent de piridoxal fosfat (PLP) de Sec en L-Ala i Se elemental. S’expressa en diferents teixits. Presenta la seva màxima activitat al fetge i al ronyó i, en canvi, no se n’observa a la sang ni al teixit adipós. Es pensa que SCL és important per al reciclatge de Se i la síntesi de selenoproteïnes. No obstant, encara s’han de resoldre detalls de la seva funció fisiològica.
Torna a dalt
Torna a la Introducció
Mecanisme i regulació d'incorporació de Sec
La incorporació cotraduccional de Sec a les proteïnes és dictada pels codons UGA presents al mRNA de les selenoproteïnes. Sec s’introdueix a les selenoproteïnes mitjançant un mecanisme complex que requereix factors trans, Sec tRNA[Ser]Sec i un element cis que és la seqüència d’inserció de Sec (SECIS).
Quan un ribosoma es troba un codó UGA, la maquinària Sec interactua amb la maquinària transcripcional canònica per augmentar el potencial codificant d’aquest codó i prevenir la terminació prematura. L’element SECIS recluta la proteïna d’unió a SECIS 2 (SBP2), que s’uneix al factor d’elongació específic de la traducció de Sec (eEFSec), impedint l’alliberament del polipèptid. eEFSec també reconeix el Sec tRNA[Ser]Sec i incorpora l’aminoàcid quan reconeix el codó, seguint amb la traducció.
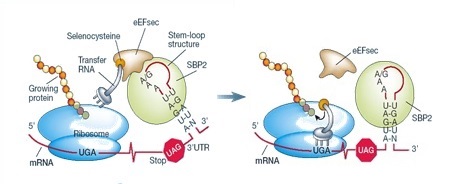
A més a més de la SBP2, s’han identificat altres proteïnes d’unió a SECIS: la proteïna ribosòmica L30, el factor eucariòtic d’iniciació 4a3 (eIF4a3) i la nucleolina.
Elements SECIS
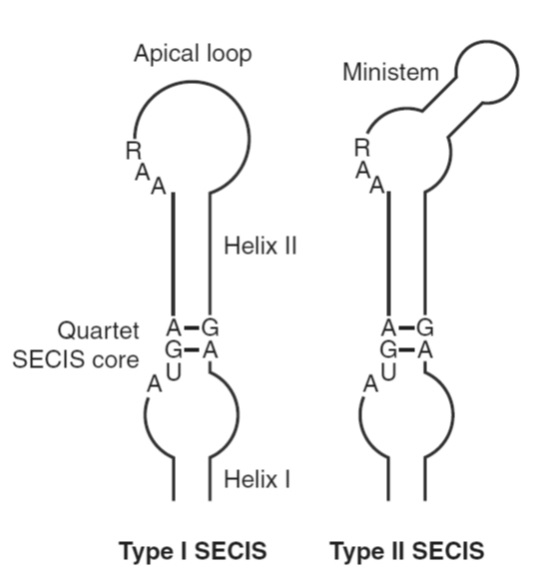
Els elements SECIS es troben en les regions 3’-UTR dels mRNAs totes les selenoproteïnes eucariotes i d’arqueobacteris. Es tracta d’una estructura stem-loop RNA que actua en cis.
Els elements SECIS d’eucariotes estan formats per dos hèlix separades per un loop intern, el core que consisteix en una estructura de quartet GA necessària per la interacció amb SBP2, i un loop o bulge apical. En funció d’aquesta última característica diferenciem els elements SECIS en dos tipus. Els de tipus I presenten un loop sense ministem (bulge), mentre que els de tipus II presenten bulge. A més a més del core, el motiu AAR de la regió apical es troba conservat i s’ha vist que és necessari per tal que es dugui a terme la incorporació de Sec.
SBP2
La SBP2 conté tres dominis diferenciats: el domini N-terminal, el domini d’incorporació de Sec (SID) al mig de la proteïna i el C-terminal que també s’anomena domini d’unió a RNA (RBD). Aquesta proteïna és un factor limitant per la síntesi de selenoproteïnes.
Factor d’elongació específic de Sec
eEFSec, de la mateixa manera que eEF1A el qual està involucrat en la incorporació dels altres 20 aminoàcids, té activitat GTPasa. No obstant, eEFSec té una alta especificitat pels tRNA[Ser]Sec aminoacilats i no s’uneix a fosfoseril-tRNA[Ser]Sec o d’altres tRNAs aminoacilats. A més a més, presenta un domini exclusiu (el IV) que està involucrat en les interaccions amb SBP2 i el braç llarg variable de Sec tRNA[Ser]Sec. S’ha vist que el complex que forma eEFSec amb SBP2 és depenent només del domini RBD de SBP2 i de l’element SECIS.
Proteïna ribosomal L30
L30 és una proteïna que forma part de la subunitat ribosomal gran dels eucariotes (60S). S’ha observat que pot unir un element SECIS mitjançant el motiu d’unió a RNA L7Ae. Tot i que la majoria de les proteïnes L30 estan associades als ribosomes, una petita part es troba de forma lliure. Aquesta fracció autoregula el splicing del seu transcrit al nucli i està involucrat en el processament del pre-rRNA al nuclèol. Cal destacar que encara fan falta estudis que detallin el paper exacte de L30 en el metabolisme de les selenoproteïnes.
Torna a dalt
Torna a la Introducció
Evolució i distribució de les selenoproteïnes
Fins al moment, s’han identificat 50 famílies de selenoproteïnes, la majoria mitjançant la bioinformàtica. Tot i que les selenoproteïnes són presents en les tres formes de vida, no ho són en igual mesura. C. elegans presenta només 1 selenoproteïna mentre que a l’Aureococcus anophagefferens se n’han trobat 59. D’altra banda, els fongs, les plantes vasculars i algunes espècies d’animals no presenten cap selenoproteïna.
S’ha observat que molts grups d’organismes terrestres han reduït la seva utilització de Se reemplaçant les selenoproteïnes per homòlegs Cys, mitjançant una mutació puntual, o bé eliminant del tot aquestes proteïnes. En canvi, la majoria d’organismes aquàtics presenten grans selenoproteomes. Això suggereix que l’ambient juga un paper en l’evolució de les selenoproteïnes.
Pel que fa als vertebrats, al selenoproteoma ancestral s’hi han trobat 28 proteïnes i als mamífers, 25. Tots els vertebrats tenen les següents 21 selenoproteïnes: GPx1-4, TR1, TR3, Dio1, Dio2, Dio3, SelH, SelI, SelK, SelM, SelN, SelO, SelP, MsrB1 (methionine-R-sulfoxide reductase 1), SelS, SelT1, SelW1, Sep15. La resta només es troben en alguns llinatges. SelT és la selenoproteïna més conservada en els mamífers, fins i tot a nivell de nucleòtids.
