No hi ha cap codó que codifiqui per Sec, per tant, la selenocisteïna ha estat inserida en polipèptids per una recodificació del codó UGA, un codó STOP. És el primer cas en què un codó en una mateixa espècie té dos significats.
1. Síntesi de l’aminoàcid selenocisteïna:
Durant la biosíntesi de selenoproteïnes, tRNAs únics que tenen codons complementaris UCA són aminoacilats amb serina formant el seril-tRNA. Aquest tRNA pot ser fosforilat per la fosfoseril tRNA quinasa (PSTK). Paral·lelament, l’enzim selenofosfat sintetasa (Sps2 en eucariotes) sintetitza el monoselenofosfat a partir de seleni ingerit per la dieta, que serà el donador de Se. Seguidament es transfereix del selenofosfat al seril-tRNA formant Sec-tRNASec.[4]
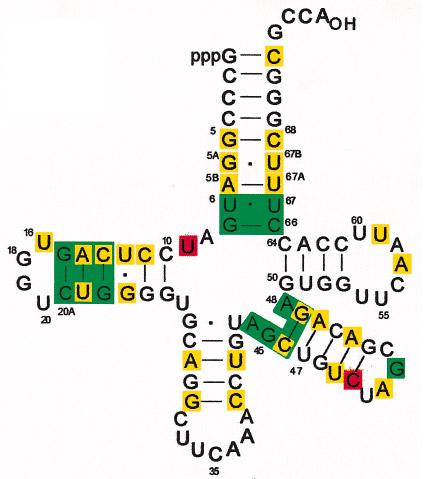
Figura 2. tRNASec
En eucariotes, les proteïnes i factors essencials per a la síntesi de Sec-tRNASec són:
- Sps1 i Sps2 (Selenofosfato Sintasa 1 i 2): són homòlegs de selD procariota, que codifica per l’enzim selenofosfat sintetasa. Sps2 és una selenoproteïna. Sps1 s’encarrega del reciclatge de la Sec i la recuperació del seleni.
- SLA/LP (Soluble Liver Antigen/Liver Pancreas): du a terme l’activitat selenocisteïna sintasa o bé sola o bé formant un complex amb SEC43p.
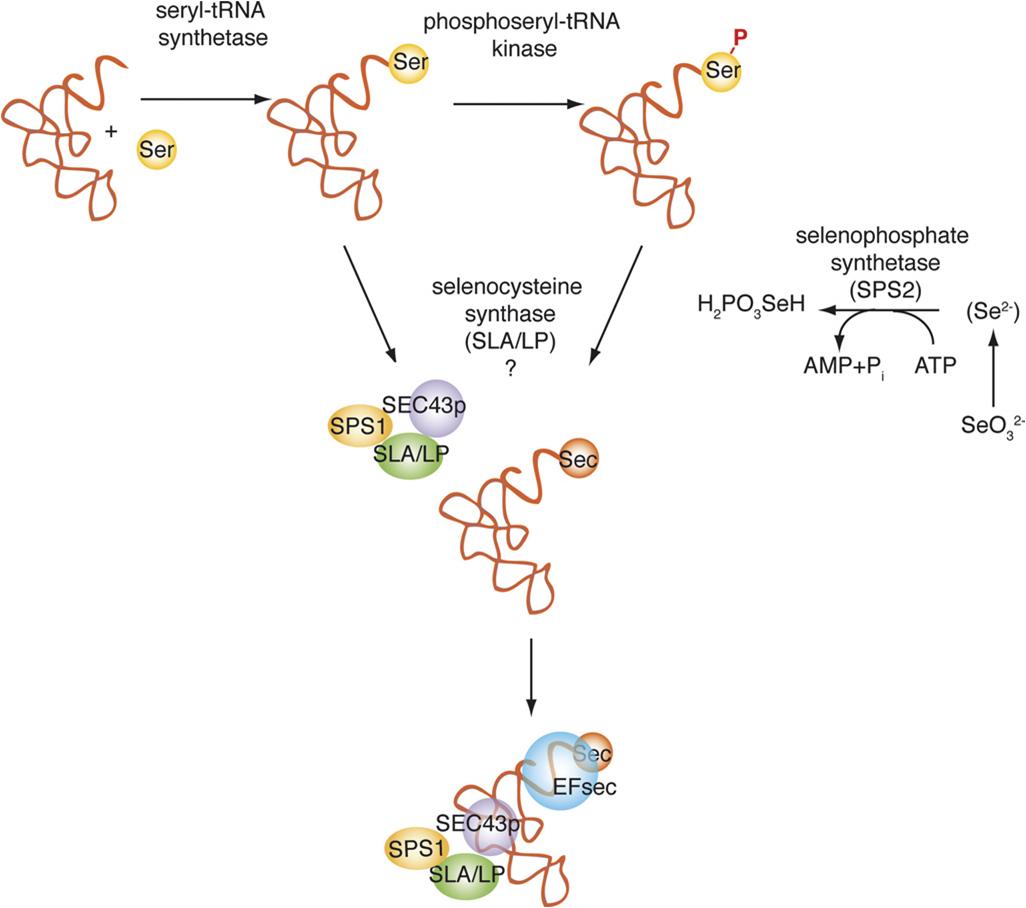
Figura 3. Síntesi de la selenocisteïna i el seu tRNA
2. Incorporació de l’aminoàcid selenocisteïna a l’estructura primària:
Per a la inserció de la Sec és necessària una senyal d'uns 60 nucleòtids al mRNA anomenada SECIS (SelenoCysteine Insertion Sequence) per a recodificar el codó nonsense a codó sense. L’element SECIS en bacteris és adjacent al codó UGA i mitjançant anàlisi mutacional s’ha vist que cada nucleòtid és requerit per a la funció correcta de l’element SECIS. En Archea i Eucariotes l’element SECIS es troba a la part 3' no traduïda del mRNA de la selenoproteïna (UTRs). Existeixen gran varietat de seqüències SECIS en aquests dos regnes, i es caracteritzen per presentar poca homologia en la seqüència primària però una estructura tridimensional molt similar. [5][6]
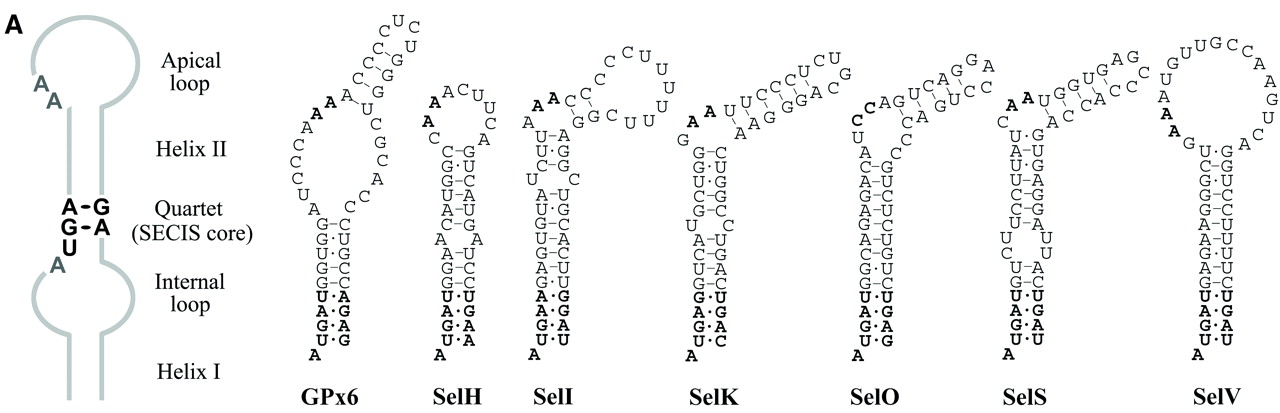
Figura 4. Estructura bàsica de SECIS i elements SECIS d'algunes selenoproteïnes humanes
La presència d’aquest element SECIS permet la unió de SBP2 (SECIS Binding Protein), que s’unirà amb el factor d’elongació eEFsec produïnt el reclutament del Sec-tRNASec.
Per tant, la incorporació de Sec a l'estructura primària de selenoproteïnes requereix la presència de:

 Contact
Contact