Selenoproteïnes:
1. El seleni
El seleni és un micronutrient, és a dir, és un element essencial en quantitats de traça per a la funció
cel•lular de la majoria dels eucariotes. En petita proporció presenta activitats antioxidants i té un efecte
protector sobre el DNA perquè contribueix a l’apoptosi i neutralitza els radicals lliures. A més a més, diversos
estudis demostren que el seleni estimula el sistema immunitari, que controla el correcte funcionament de la
glàndula tiroides i que, gràcies a les seves propietats antioxidants, ajuda a prevenir l’aparició de determinats
càncers en humans.
La manca de seleni pot causar diferents disfuncions com la malaltia de Keshan (causa problemes musculars greus i
cardíacs però es poden prevenir amb l’administració de suplements de seleni), mentre que l’excés de seleni pot ser
tòxic, causant efectes prooxidants, entre d’altres.
El seleni està present exclusivament en l’aminoàcid 21, la selenocisteïna, codificada pel codó UGA.
Aquest aminoàcid forma part de diverses proteïnes anomenades selenoproteïnes amb activitats enzimàtiques diverses.
2. Les selenoproteïnes
Des del seu descobriment, s’han anat descrivint en els tres regnes: eucariotes, bactèries i arquees i s’han
identificat més de 30 famílies diferents. Hi ha una gran varietat en el número de selenoproteïnes presents a les
diferents espècies; per exemple en C. elegans s’ha trobat només una però en humans s’han anotat al genoma
unes 25.
Les selenoproteïnes són un tipus de proteïnes que contenen al menys un aminoàcid de selenocisteïna a la seva
estructura primària. Aquest aminoàcid (Sec) és molt similar a la cisteïna però conté seleni en la seva estructura
en comptes de sofre. Està codificat pel codó UGA, que en la resta de proteïnes codifica per un codó de terminació
de la traducció, però que en aquest cas comporta la introducció de Sec en la seqüència d’aminoàcids.
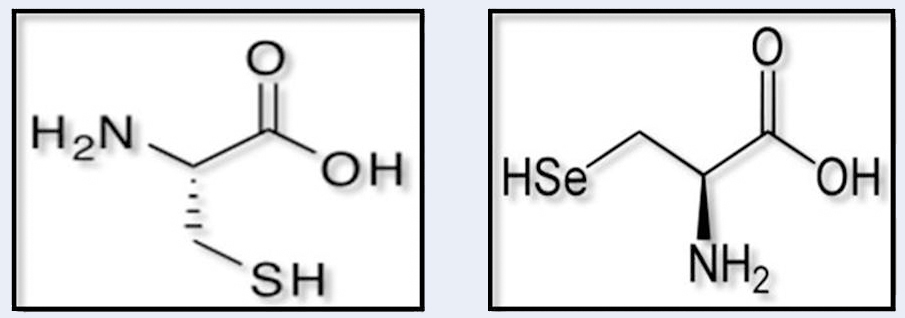
Figura: Esquema de l’estructura d’un aminoàcid de cisteïna (a l’esquerra) i d’una selenocisteïna (a la dreta). Es pot observar que la única diferencia és la presencia de seleni en comptes de sofre en la selenoproteïna respecte la cisteïna.
La dualitat del codó UGA en les selenoproteïnes les fa indetectables per a programes de selecció de gens i, conseqüentment, els gens que les codifiquen estan incorrectament anotats en els genomes de molts organismes, tant eucariotes com procariotes.
Hi ha una sèrie de factors implicats perquè el codó UGA doni lloc a la incorporació d’una selenoproteïna i no a un senyal de terminació.
Els elements SECIS (Selenocystein Insertion Sequence) són un motiu estructural del mRNA format per una seqüència de nucleòtids i una estructura secundària característica (normalment dues hèlix, un loop intern i un altre apical). Presenten una estructura stem-loop derivada de l’aparellament de bases del mRNA.
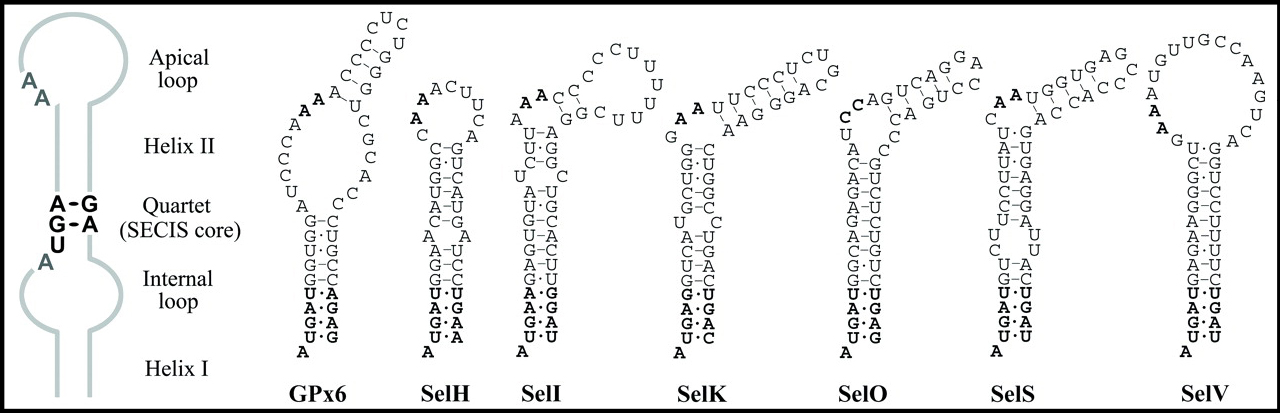
Figura: Esquema dels diferents tipus d’elements SECIS segons cada família de selenoproteïnes. Tot i així, hi ha molta diversitat dins de cada família i per aquest motiu són molt difícils de trobar.
En procariotes estan presents downstream del codó UGA però en eucariotes es troben en la regió no codificant 3’-UTR dels mRNAs.
Quan hi ha un codó UGA i hi ha elements SECIS presents es pot incorporar una selenocisteïna a la seqüència nucleotídica. Per contra, si no hi ha elements SECIS, el codó UGA actua com un factor de terminació i es finalitza la traducció de la proteïna.
La selenocisteïna no s’uneix directament al seu tRNA ja que el tRNA està inicialment unit a una serina i gràcies a una reacció enzimàtica es produeix el tRNA unit a la selenocisteïna.
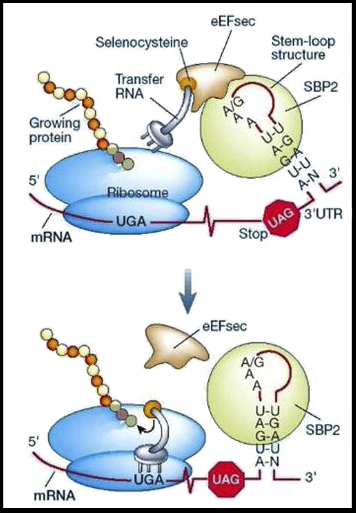
Figura: Esquema del procés d’incorporació d’una selenocisteïna en una seqüència proteica i dels elements que faciliten el procés. Imatge codi genètic: Imatge on s’observa la correspondència entre el triplet de nucleòtids (codó) i l’aminoàcid que codifica. Hi ha 64 combinacions possibles, però només 61 codifiquen per 20 aminoàcids diferents (codi genètic degenerat). Hi ha 3 combinacions que donen senyals de terminació de la traducció: UAA, UAG, UGA i és aquesta última la que també pot codificar per l’aminoàcid número 21, la selenocisteïna.
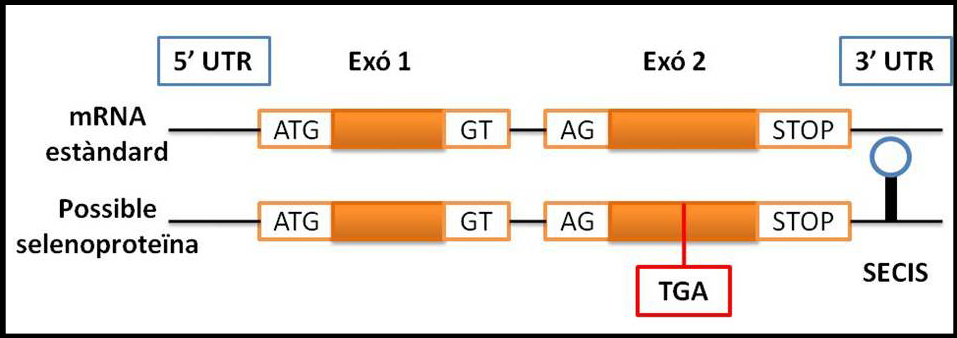
Figura: Esquema comparatiu entre un fragment d’un mRNA estàndard (a dalt) i un fragment d’un que codificarà per una selenoproteïna (a baix). Es pot observar com és imprescindible que hi hagi un codó UGA i un element SECIS a 3’UTR però no és suficient.
3. Les selenoproteïnes en els genomes dels protists
Actualment es té una visió una mica confosa sobre l’evolució de les selenoproteïnes. Semblen no seguir la historia evolutiva “acceptada”, és a dir, estan presents en determinades espècies o grups taxonòmics però no en altres molt propers filogenèticament. A més a més, poden estar com a selenoproteïnes o com a homòlegs en cisteïna en grups taxonòmics diversos.
Fins fa un cert temps es pensava que eren essencials per a la vida, però l’anotació de diversos genomes de diferents espècies de Drosophila ha demostrat que algunes espècies no contenen selenoproteïnes, concloent que no són vitals.
Per tant, l’estudi d’aquestes proteïnes als genomes dels protists (organismes eucariotes unicel•lulars) que presenten una gran diversitat taxonòmica i distancia filogenètica, demostren que la distribució de les selenoproteïnes és molt diversa i irregular. És molt important cercar selenoproteïnes als genomes de protists recentment seqüenciats per poder intentar esbrinar la historia evolutiva de les diferents famílies de selenoproteïnes.
4. Famílies de selenoproteïnes estudiades
Aquest treball està centrat en la cerca de 3 famílies de selenoproteïnes diferents en tretze espècies de protists seqüenciats durant l’any 2010.
La Sel15 o Sep15 o 15KDa selenoproteïna presenta 5 exons i 4 introns i està localitzada a la regió 1p31 del cromosoma 1 en humans. Està present en humans i en ratolins expressant-se preferiblement a la pròstata, fetge i ronyons però també s’ha trobat a altres espècies d’eucariotes. El cDNA codifica per 162 residus que contenen el codó UGA que comporta la incorporació de la selenocisteïna en el codó 93. Els elements SECIS estan presents en la regió 3’-UTR de l’mRNA en els eucariotes superiors, com seria el cas d’humans i ratolins però just downstream del codó UGA en les bactèries que contenen aquesta selenoproteïnes.
Sel15 i SelM són homòlogues estructuralment i estàn presents des d’algunes algues verdes fins a humans i presenten activitat tiorredoxina (TRX), és a dir, actuen com antioxidants, facilitant la reducció d’altres proteïnes a través d’un intercanvi tiol-disulfur en la cisteïna (o selenocisteïna). Per tant, estan implicades en el correcte plegament de les proteïnes mitjançant els enllaços disulfur al reticle endoplasmàtic perquè lliguen la UDP-glucosa (glicoproteïna glucosiltransferasa), un marcador de plegament proteïc.
En mamífers, l’expressió de Sel15 està regulada per la quantitat de seleni present a la cèl•lula i un augment o disminució de la quantitat de Sel15 altera l’homeòstasi redox. Alguns experiments demostren que la pèrdua d’heterozigositat en el locus de Sel15 està present en el desenvolupament d’alguns tipus de tumors humans.
La selenoproteïna P (SelP) és una proteïna força especial donat que la seva forma sencera conté 10 residus de selenocisteína (Sec), això vol dir que hi ha 10 codons en el seu marc de lectura que es podrien interpretar com a stop codon.
Donades aquestes característiques s'interpreta que la funció principal d'aquesta proteïna està basada en el transport de seleni, això es basa també en que conté entre un 40 i un 50% del seleni que es troba a la sang. S'han fet estudis amb ratolins Knock Out (KO) de SelP i s'ha vist que aquests ratolins tenen problemes neurològics i d'esterilitat als mascles (es va veure amb Se radioactiu que hi havia menys concentració de Se als testicles però major al fetge). El fetge és l'òrgan d'acumulació i distribució al torrent sanguini del Se, on no cal que existeixi el receptor ApoER2 que sí és necessari en l'uptake del Se als testicles. Entre les seves funcions també es troba que pot unir heparina i metalls pesants.
En l'àmbit clínic es troba relacionat amb diverses malalties parasitàries com la triponosomiasis africana, donat que el clearance d'aquestes requereix un alt nivell d'estrés oxidatiu en fagòcits i la seva viabilitat depèn dels nivells de Se i, per tant, dels nivells de SelP. També es pensa que pot estar relacionat amb la malaltia d'Alzheimer perquè s'ha vist colocalització de SelP amb les plaques amiloidees.
Només s'ha trobat expressió en vertebrats i s'expressa en el cromosoma 5 d'humà.
Referent a l'estructura de la proteïna, se sap que té 5 exons (un d'ells no és codificat) i 5 elements SECIS. La distribució dels residus Sec no és uniforme donat que el primer es troba a l'exó 2 i els altres 9 a l'exó 10. Això defineix dos dominis, un que va des de l'N terminal fins al segon residu de Sec i un segon domini que va del segon residu Sec fins al C-terminal. El primer té un residu Sec i 17 cisteïna (Cys) amb activitat glutatione reductasa amb funció redox. L'altre presenta 9 Sec i 10 Cys y té funció de transportar Se per la sang.
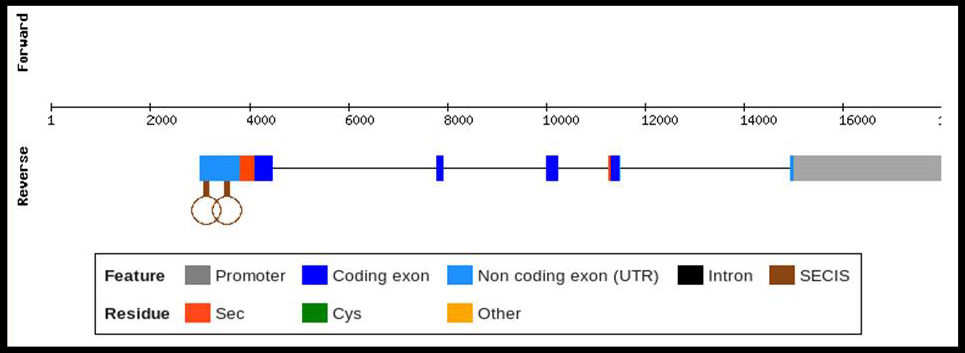
Figura: Estructura de SelP, on veiem el promotor, els 5 exons, els residus Sec i els element SECIS.
La Selenoproteïna L (SelL) és una selenoproteïna de la que existeix poca informació, i que en principi, es troba només en organismes marins, tant vertebrats, invertebrats i bactèries. Fins al moment segons Schedrina VA i cols, només s'han trobat 18 espècies amb SelL: 11 peixos, 2 ascídies, 2 crustacis, 1 molusc i 2 organismes procariotes desconeguts.
Entre les seves característiques s'observa que conté 2 residus Sec separats per dos aminoàcids qualsevol (UxxU), això és un motiu d'un domini anomenat Prx-like2 que es troba a les proteïnes Trx (CxxC) que contenen moltes tioredoxines. SelL es centra, com altres selenoproteïnes, en el manteniment de l'equilibri redox.
Pel que fa a la seva estructura, conté un SECIS per als dos residus Sec tant en eucariotes com en procariotes però difereix en la posició d'aquest. En eucariotes es localitza en el 3'UTR i en els procariotes es troba dins de la regió codificant.
Una característica important d'aquesta selenoproteïna és que s'ha trobat un pont diselènid en el motiu UxxU (quelcom que no s'havia descobert fins al moment). Schedrina VA i cols, mitjançant RPS-BLAST, han identificat un domini Prx-like, que forma part de les tiorredoxines, i es localitza en l'extrem C-terminal de la proteïna i les regions que ho flanquegen estan conservades.
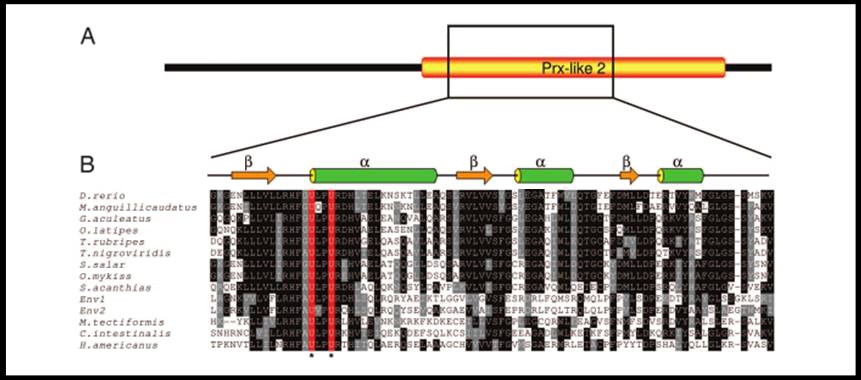
Figura: Conservació del domini Prx-like2 de Selenoproteïna L en diferents organismes. Conservació total del motiu UxxU.
© Creat pel grup Ax de bioinformàtica l'any 2011 | Contactan's! | Agraïments |