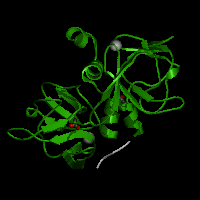
FAMILIA MsrA
MsrA es una selenoproteína que pertenece a la familia de las Msrs (metionina sulfóxido reductasas). Su principal característica es la capacidad de catalizar la conversión de metionina a metionina sulfóxido (dependiente de tiol). Esta enzima se caracteriza por tener un importante papel en la protección de las proteínas celulares al estrés oxidativo, y está implicada en retardar el proceso y la progresión de enfermedades neurodegenerativas. Se trata de una proteína citosólica y nuclear.
La selenocisteína que incorpora, ofrece ventajas a la función catalítica de las proteínas de reparación en los residuos metionina de las proteínas, pero sin embargo las hace dependientes del selenio, y requiere también ajustes en sus estrategias para la regeneración de enzimas activas.
MsrA fue descubierta en mamíferos, pero se han descrito en organismos simples como algas verdes y bacterias, pero se conocen homólogos de la misma con cisteína en otras especies.
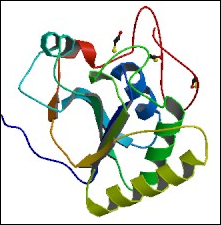
FAMILIA SelR
La selenoproteína SelR pertenece a la familia de proteínas MsrB1 y a la subfamilia de las Meteionina-R-sulfóxido reductasa. Es una proteína tanto citosólica como nuclear. Estudios de SelR nos ponen en conocimiento que todos los organismos invertebrados que tienen SelR son homólogos con cisteína, y que el patrón de expresión de dicha proteína se pierde independientemente durante la evolución.
Esta selenoproteína cataliza la reducción de los sulfóxidos de metionina en una reacción dependiente del NADPH. Esta reacción está implicada en numerosos procesos biológicos incluyendo función antioxidante, señalización celular y regulación de la actividad enzimática.
En algunos de estos genomas los genes de SelR y MsrA se encuentran fusionados, y sus patrones de expresión sugieren que las dos proteínas actúan proteguiendo a la célula del estrés oxidativo.