PTEROPUS ALECTO
El Pteropus alecto, conegut popularment com a “guineu negra voladora”, és un rat-penat de grans dimensions de l'ordre Chiroptea i família Pteropodidae

Descripció física
Té el cos i el cap negre, amb un collar vermellós darrera el coll i un anell marró als ulls. Té les cames molt peludes fins al genoll, però per sota no té pèl. L'avantbraç sol medir de 153 a 191 mm i el pes mitjà és de 667 grams.
Hàbitat
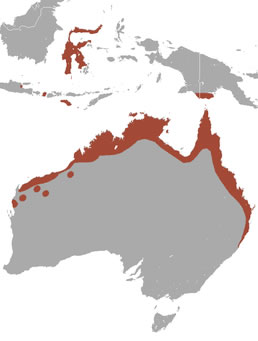
Aquest animal es troba principalment a les latituds tropicals i subtropicals australianes, de 0 a 29º sud. El seu hàbitat són principalment les selves, els boscos d'eucaliptus, els boscos de bambú i la sabana, tot i que se n'han trobat en coves també. Durant les estacions fredes viuen majoritàriament en boscos de bambú, i ben pocs habiten a les selves. En canvi, durant les estacions estiuenques i les humides, la majoria viuen a les selves.
Reproducció i creixement
Són animals vivípars, dels qual es té molt poca informació relativa a la reproducció. Els pics de naixements estan correlacionats amb els períodes de màxima productivitat de plantes, així que varien amb el territori. Els intervals de reproducció són anuals i el nombre mig de descendència és d'1.2 rat-penats.
Les femelles tarden de 14.8 a 17 mesos a fer-se adultes, mentre que els mascles en tarden de 16.3 a 18. Les femelles guanyen uns 2.56 grams de pes per dia i els seus avantbraços creixen uns 0.25mm per dia. Els mascles, en canvi, guanyen uns 2.28 grams de pes al dia i els seus avantbraços creixen uns 0,15mm al dia.
Longevitat
No se sap ben bé quant viuen, però es creu que les femelles han de viure uns 7 anys per poder mantenir una població estable. Una aproximació que s'ha realitzat és que viuen uns 4.5 anys en llibertat i uns 19.7 en captivitat.
Aproximadament un 30% de les femelles sobreviu a la maduresa, respecte un 37% de mascles. Però s'ha de tenir en compte que la taxa de supervivència depèn molt de quina hagi estat l'abundància de fruita aquell any.
Comportament
Com la majoria de rat-penats, són animals nocturns, que durant el dia descansen a un camp base. Els mascles són els que viatgen més durant aquelles hores (uns 6.8km respecte els 5.8km de les femelles), a excepció de les èpoques de cria, quan són les femelles les que viatgen més. Per buscar lloc per dormir es repeteix aquest últim patró, ja que les femelles viatgen una mitja de 10,9 km i els mascles un 6,2km. Ambdós viatgen més durant les estacions seques que les altres.
Hàbitats alimentaris
Aquests rat-penats s'alimenten bàsicament de fruites, pol·len i nèctar de 23 espècies de la selva (Carpentaria acuminata, Terminalia microcarpa, Diospyros littorea, Elaeocarpus arnhemicus, Ficus opposita, Ficus racemosa, Ficus scobina, Ficus virens, Eucalyptus miniata, Eucalyptus papuana, Eucalyptus polycarpa, Eucalyptus tetrodonta, Lophostemon grandiflorus, Lophostemon lactifluus, Melaleuca dealbata, Melaleuca viridiflora, Syzygium nervosum, Passiflora foetida, Grevillea pteridifolia, Nauclea orientalis, Timonius timon, Cupaniopsis anacardioides, and Gmelina schlechteri), però depèn molt de l 'estació de l'any i de la productivitat de les plantes.
Paper a l'ecosistema
El Pteropus alecto juga un paper clau en connectar regions aïllades de la selva, transportant llavors i pol·len entre els camps bases. és un pol·linitzador molt important de dues espècies d'eucaliptus del nord d'Austràlia i també un important pol·linitzador i dispersador de llavors de l'espècie Syzygium.
La seva importància econòmica per als humans és en part positiva, ja que suposa una font d'aliment, però també negativa, ja que la indústria hortícola perd uns 20 milions de dòlars a l'any.
D’altra banda és important destacar que els ratpenats, entre els quals s'inclou el Pteropus alecto, són els únics mamífers voladors. Aquest fet fa que sigui un animal molt exposat a patògens diferents, pels quals ha esdevingut resistent i s'ha convertit en un reservori d'aquests. Per exemple, és portador del virus Lyssavirus, semblant a la ràbia. Per tal de poder fer fronts als múltiples patògens s’han seleccionat positivament vies d’oxidació fosforilativa (OXPHOS). Ara bé, com a contrapartida això suposa un augment d’espècies reactives d’oxigen (ROS), que poden produir dany al DNA. Aquest últim fet, ha estat relacionat amb la selecció de gens implicats en la supervivència relacionada amb aquest dany genètic, com serien MDM2 o p53. Sabem que les selenoproteïnes també tenen un paper important en la protecció de les espècies oxidatives, de manera que esperem que Pteropus alecto presenti un bon selenoproteoma.
SELENOPROTEÏNES
Seleni
El seleni és un element traça de nombre atòmic 34, àmpliament distribuït a l'escorça terrestre. Malgrat que els seus nivells són molt baixos a l'organisme, juga un paper destacat entre els diferents metalls perquè és l'únic que requereix d'un sistema genèticament codificat per a la seva incorporació en les proteïnes.
Selenocisteïnes
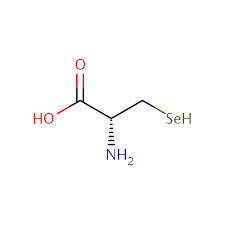
Les selenoproteïnes són aquelles proteïnes que contenen seleni. Aquest seleni es troba a un aminoàcid anomenat selenocisteïna, que es coneix com el 21è aminoàcid. La selenocisteïna s’abreuja com a Sec i té la mateixa estructura que la cisteïna però enlloc de tenir un àtom de sofre té un àtom de seleni.
Les propietats químiques d’aquests dos aminoàcids també s’assemblen, però les selenocisteïnes tenen un pKa menor (5,3) i són més més nucleofíliques, per tant, tendeixen a reaccionar més.
A la cèl•lula no trobem reserves de selenocisteïnes lliures i durant el seu catabolisme de seguida s’allibera el seleni. D’una banda és important que no hi hagi selenocisteïnes lliures ja que si n’hi hagués podria incorporar-se enlloc de la cisteïna, augmentant la reactivitat de la proteïna. D’altra banda, la presència d’aquests aminoàcids podria promoure la creació d’espècies reactives d’oxigen.
Actualment es coneixen 25 selenoproteïnes humanes i també se'n coneixen d’altres organismes. La meitat de les selenoproteïnes de mamífers encara tenen una funció desconeguda. Respecte a les proteïnes amb funció coneguda, la meitat estan involucrades en la regulació redox. Altres han estat relacionades amb el càncer, l’envelliment, el sistema immunitari i la reproducció masculina.
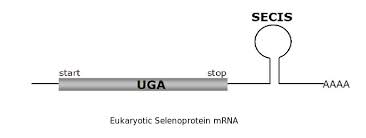
La selenocisteïna està codificada pel triplet UGA, que en la majoria de casos és un codó stop, però en alguns casos codifica per Sec. S'han identificat els diferents components clau de la maquinària de traducció de les selenoproteïnes, però el mecanisme pel qual el ribosoma incorpora una selenocisteïna en determinats codons UGA encara no està clar. Tot i així, se sap que per tal que la maquinària transcripcional interpreti aquest codó d'aquesta manera, és necessària la presència de diversos elements:
- Elements en cis
- Proteïnes necessàries per sintetitzar l'aminoàcid selenocisteïna
- Proteïnes que participen en la incorporació de la Sec en les selenoproteïnes
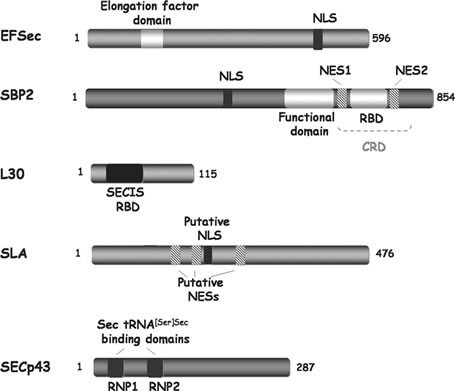
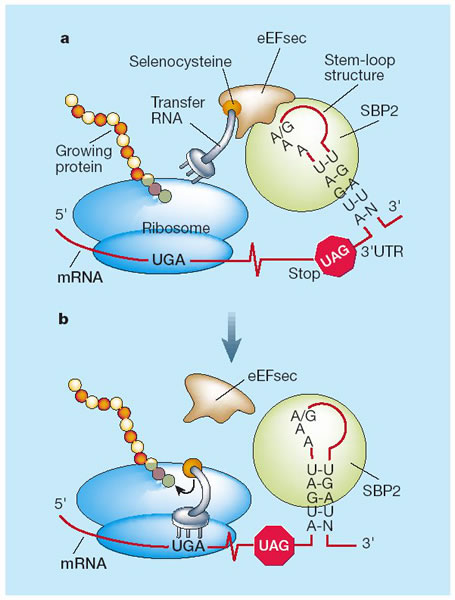
- SECIS binding protein 2 (SBP2). és una proteïna de 854 aminoàcids i forma part d’un complex multiproteic format per EFSec, SECp43, SPS1 i SLA que està implicat en la síntesi i incorporació de les selenocisteïnes. Presenta dominis de localització i exportació nuclears, un domini d’unió al RNA, un domini funcional dispensable per la unió als elements SECIS però necessari per incorporar la selenocisteïna i un domini d’interacció amb els ribosomes.
- Factor d’elongació específic de Sec (mSelB/eEFSec). Interacciona amb totes les isoformes del Sec tRNA[Ser]Sec i també amb SBP2. El seu paper en la incorporació sembla ser complex, ja que implica tant la via de biosíntesis com la d’incorporació de la selenocisteïna i sembla que interacciona amb la majoria de components proteics i RNA de la maquinària de síntesi.
- Proteïna ribosomal L30. és una proteïna de 43 kDa i pertany a la família de les proteïnes ribosomals L7Ae. Té un domini d’unió a RNA i és un component essencial del ribosom. és un component de la maquinària de reconeixement de les UGA en les selenocisteïnes i s’uneix específicament als elements SECIS. Sembla que SBP2 i L30 no s’uneixen a la vegada en els elements SECIS, sinó que competeixen entre elles i es desplacen.
- SLA. és un antigen soluble que es sintetitza al fetge. S’associa amb la molècula de tRNA[Ser]Sec i s’ha vist que funciona en el procés final de la via de síntesi de selenocisteïna.
- Secp43. Té dos dominis d’unió a ribonuceloproteïnes i forma un complex amb SLA i SPS1 important per incorporar el Sec-tRNA[Ser]Sec a la selenoproteïna. També s’ha demostrat que té un paper en la formació i estabilització del complex EFSec–SBP2– Sec tRNA[Ser]Sec
El mecanisme mitjançant el qual aquest codó s’interpreta de manera diferent està mediat per l’extrem 3’ UTR (final del mRNA), on hi trobem l’estructura tridimensional anomenada SECIs (Selenocystein Insercion Sequence).
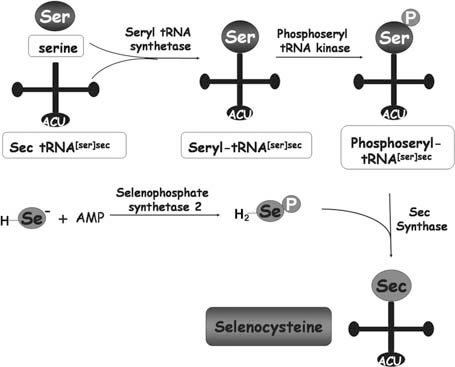
A diferència de la resta d'aminoàcids, la selenocisteïna es sintetitza en el propi tRNA emprant una serina com a intermediari, anomenat Sec tRNA[Ser]Sec. El procés d'inicia amb la unió de la serina al Sec tRNA[Ser]Sec donant lloc al Seril-tRNA[Ser]Sec per part de la tRNA seril sintetasa. A continuació, la fosfoseril-tRNA[Ser]Sec quinasa (PTK) fosforila especifícament el complex i la selenofosfat sintetasa substitueix el fosfat per un donador de seleni anomenat monoseleniofosfat (H2Se-P), que ha estat generat per la selenofosfat sintetasa 2 (SPS2).
El procés de biosíntesi de selenoproteïnes requereix la cooperació activa entre diversos factors. Aquests poden presentar diversos dominis funcionals: - NLS. Senyal de localització nuclear - NES. Senyal d'exportació nuclear - RBD. RNA-binding domain - CRD. Dimini ric en cisteïna En els darrers anys s'han descrit npus factors implicats en la síntesi de selenoproteïnes, així com noves interaccions moleculars entre aquests.
Selenoproteoma
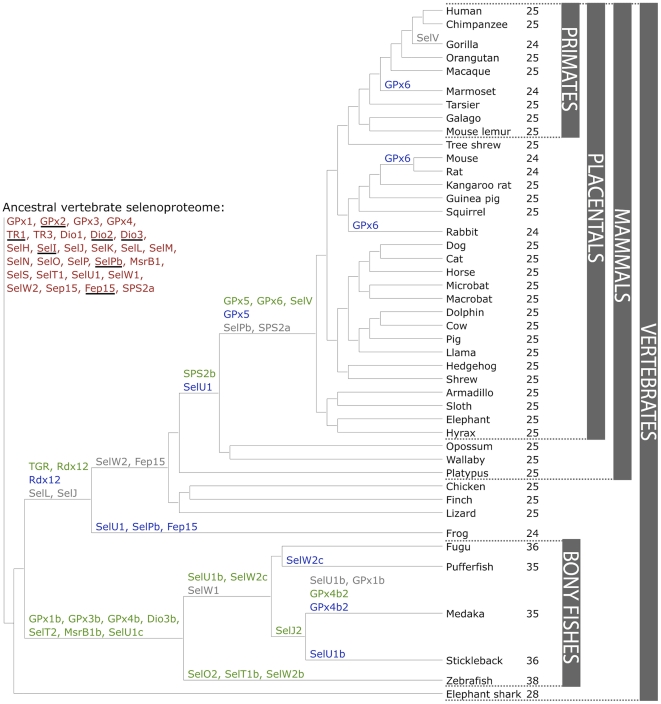
Gràcies a la predicció de gens i als mètodes de reconstrucció filogenètica ha estat possible descriure el selenoproteoma ancestral de vertebrats i mamífers. Malgrat això, l'evolució del selenoproteoma de vertebrats resta parcialment desconeguda.
D'entre tots els vertebrats s'han pogut identificar fins 45 subfamílies de selenoproteïnes, 28 de les quals en mamífers. Aquestes selenoproteïnes que avui dia coneixem són el resultat d’un procés evolutiu que ha tingut lloc entre els diferents llinatges, que pot comprendre tres esdeveniment diferents: la duplicació gènica (20 events), la pèrdua de gens (10 events) i la substitució de la selenocisteïna per cisteïna (12 events).
L’evolució del selenoproteoma ancestral no ha estat igual en el diferents llinatges. De fet, cada selenoproteïna sembla haver evolucionat d’una manera particular, podent estar present en determinades espècies o en tot un grup taxonòmic i, en canvi, trobar-se absents en un grup filogenètic proper. Els organismes aquàtics generalment presenten un selenoproteoma més gran que els terrestres ja que els mamífers mostren una tendència evolutiva cap al desús d’aquestes proteïnes. D’aquesta manera alguns dels esdeveniments que permeten explicar aquesta divergència evolutiva serien la duplicació gènica, com en el cas dels osteïctis, o la conversió de selenoproteïna a homòleg de cisteïna, com en el cas d’alguns mamífers. Així doncs, no és estrany que el selenoproteoma més gran hagi estat trobat en el peix zebra i que el menor ho hagi estat en la granota i en alguns mamífers.
Anotació de genomes
Actualment encara falta anotar moltes selenoproteïnes en la majoria de genomes. Aquesta tasca no és fàcil, ja que quasi tots els programes interpreten el codó UGA com un codó STOP i no contemplen l’existència de selenoproteïnes. Per aquest motiu, cal utilitzar programes específics per trobar-les. Aquests programes es basen en trobar proteïnes que tinguin un codó UGA dins d’un perfil d’exó i un element SECI a la regió 3’UTR. Alternativament, també es pot fer a partir de l’alineament de seqüències, ja que s’ha vist que les selenoproteïnes estan força conservades al llarg de l’evolució i trobem homòlegs en diferents espècies i classes filogenètiques. Aquesta segona aproximació és la que seguirem en el nostre estudi. Partirem de les selenoproteïnes humanes, ja que són les més ben anotades, però també contemplarem selenoproteïnes que es troben en espècies filogenètiques semblants, en aquest cas el Pteropus Vampyrus.
A la taula que hi ha a continuació hi ha totes les selenoproteïnes que alinearem amb el genoma de Pteropus alecto:
| Selenoproteïna |
Funció |
| Selenoproteina de 15KDa (Sel15) |
És una proteïna del tipus de les tioredoxines i forma part del control de qualitat en resposta a proteïnes mal plegades del RE, la via UPDR(unfolded protein response). Està regulada per aquesta via i pels nivells dietètics de seleni. |
| eEFSec |
Maquinària |
| Glutatuió peroxidasa (GPx) |
Grup de proteïnes que s’encarreguen de protegir-nos de l’estrés oxidatiu. Hi ha vàries isoformes, actuen a llocs diferents. |
| Iodotironina deionidasa (ID) |
S’encarreguen de regular el nivell d’activació de les hormones tiroidees. |
| Reductasa sulfòxid metionina A (MsrA) |
Reverteix l’oxidació de les metionines, protegint-nos de dany oxidatiu, ja que redueix la sulfòxid metionina a metionina. |
| Quinasa fosfoseril-tRNA (PSTK) |
Síntesi-regulació selenoproteïnes |
| SECIs binding protein 2 (SBP2) |
Maquinària |
| Selenocisteïna sintasa |
Maquinària |
| Selenofosfat sintetasa |
Maquinària |
| Selenoproteïna H (SelH) |
Sembla que està relacionada amb la protecció de radicals lliures. Es troba al nucli.
|
| Selenoproteïna I (SelI) |
No té funció coneguda
|
| Selenoproteïna K (SelK) |
Es troba al RE de cèl·lules cardíaques, on es creu que té una funció antioxidant. |
| Selenoproteïna M
|
Protegeix de l’estrès oxidatiu |
| Selenoproteïna N |
La seva funció no està clara. Està molt activa en teixits fetals, en la miogènesi i la trobem vinculada en la correcta funcionalitat dels músculs (té dominis d’interacció amb el calci). |
| Selenoproteïna O |
Funció desconeguda |
| Selenoproteïna P |
Glicoproteïna extracel·lular amb un domini d'interacció amb la heparina que es troba a les cèl·lules endotelials. Té una funció antioxidant i està implicada en el transport de seleni en diferents òrgans i teixits
|
| Selenoproteïna R |
S'encarrega de reduir residus oxidats de metionina a les proteïnes |
| Selenoproteïna S |
Regula la producció de citoquines i juga un paper essencial en la resposta inflamatòria |
| Selenoproteïna T |
Funció desconeguda. Està localitzada a l'aparell de Golgi i al Reticle endoplasmàtic. La seva deficiència altera l'adhesió cel·lular i millora la expressió de gens oxidoreductors. Es sospita que estigui implicada, doncs, en processos d'organització i ancoratge cel·lular. |
| Selenoproteïna U |
Funció desconeguda |
| Selenoproteïna V |
Funció desconeguda |
| Selenoproteïna W |
Es creu que actua com a antioxidant, resposta a estrès; està relacionada amb la immunitat i és un target específic pel metilmercuri (degut al poder tioreductor de la selenoproteïna). |
| Thioredoxin reductase |
S’encarrega de reduïr la tioredoxina utilitzant NADPH com a agent reductor. Media el pas final de la transferència d’electrons per la reducció de nucleòsids difosfat |
| tRNA Sec 1 associated protein 1 (SECp43) |
Maquinària |
(5)
QUÈ ESPEREM TROBAR?
D’entre les 28 subfamílies de selenoproteïnes identificades en els vertebrats ancestrals, n'hi ha 21 que es troben en tots els vertebrats i que esperaríem trobar a Pteroptus alecto: GPx1-4, TR1, TR3, DI1, DI2, DI3, SelH, SelI, SelK, SelM, SelN, SelO, SelP, MsrB1, SelS, SelT1, SelW1 i Sep15.
