Introducción
Cáncer de vejiga
¿Qué es?
La mucosa de la vejiga está compuesta por una capa de células que protegen los tejidos internos de la orina. En algunas ocasiones estas células empiezan a multiplicarse incontroladamente y forman un tumor.
Las células anormales no son siempre cancerosas y por esta razón debe realizarse una biopsia para determinar cuando las células son benignas o malignas (cancerosas). El cáncer puede invadir estructuras cercanas y difundir por otras partes del cuerpo, para evitarlo es importante detectar y tratar esta enfermedad en estadíos tempranos.
Factores de riesgo
Las causas del cáncer de vejiga no son conocidas. Se piensa que un cúmulo de determinados factores hace que se produzcan las células malignas. Entre estos factores destacan:
- El consumo de tabaco que es el factor de riesgo individual más fuerte y la causa subyacente de al menos la mitad de todos los casos.
- La exposición a determinadas sustancias industriales como disolventes y colorantes.
- Algunos trabajos que requieren la exposición o el contacto con determinadas sustancias o materiales como son los tintes y aceites industriales, la industria textil, cuero, caucho, pintores, industrias químicas y trabajadores del aluminio.
- La esquistosomiasis, una infestación producida por parásitos, produce una irritación crónica en la vejiga que puede originar un cáncer.
- Las infecciones urinarias repetidas producen una irritación de la pared de la vejiga que parece que puede ocasionar cáncer.
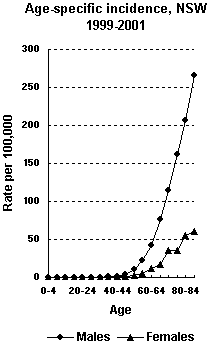
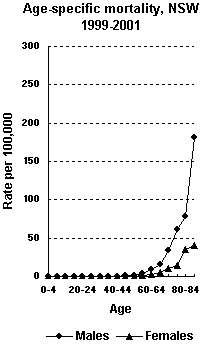
Este cáncer es inusual en personas menores de 40 años. Los hombres lo padecen 3 veces más que las mujeres y los fumadores tienen un riesgo mayor de desarrollar este tipo de cáncer. También la exposición a ciertos productos químicos en el ambiente laboral está asociado a un aumento del riesgo.
El pronóstico depende del estadio siendo peor en aquellos tumores en los que hay afectación ganglionar o metástasis a distancia. El índice de supervivencia a cinco años, en estos casos, oscila entre el 10-20%.
 |
 |
Etapas
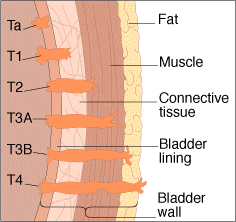
- TX: Tumor primario que no puede ser evaluado.
- T0: No hay evidencia de tumor primario.
- Ta: Carcinoma in situ
- T1: El tumor invade la lámina propia o el músculo.
- T1a: El tumor invade la lámina propia.
- T1b: El tumor invade el músculo.
- T2: El tumor invade el tejido conectivo perimuscular.; no se ha extendido hacia la serosa o hacia el hígado.
- T3: El tumor perfora la serosa (peritoneo visceral), invade directamente algún órgano adyacente o ambas situaciones simultáneamente.
- T4: El tumor se extiende más de 2 cm en el hígado y/o en 2 o más órganos adyacentes (estómago, duodeno, colon, páncreas...)
 |
Tratamiento
Existen cuatro tipos de tratamientos para el cáncer de vejiga que son:
Cirugía: consiste en extraer, a partir de una intervención quirúrgica, el cáncer de la vejiga.
Radioterapia: emplea radiaciones X de alta energía para destruir las células cancerosas. Se utiliza un aparato llamado acelerador lineal que envía los rayos sólo a la zona afectada. Se pueden emplear materiales que producen radiación a través de tubos plásticos delgados aplicados al área donde se encuentran las células cancerosas.
Quimioterapia: consiste en el empleo de medicamentos para destruir las células cancerosas. Estos fármacos pueden administrarse por varias vías, oral, intravenosa, intramuscular, etc. La quimioterapia puede utilizarse después de la intervención quirúrgica para asegurar la eliminación total de las células cancerosas.
Terapia biológica: se emplean materiales producidos por el cuerpo o fabricados en una laboratorio para aumentar, dirigir o restablecer las defensas naturales del cuerpo contra la enfermedad. Este tratamiento puede introducirse mediante un tubo colocado en la uretra.
Terapia fotodinámica: consiste en el empleo de luz y medicamentos especiales para destruir las células cancerosas. El medicamento hace que las células cancerosas sean más sensibles a la luz, que es especial para iluminar la vejiga. Este tratamiento se emplea en las etapas iniciales del cáncer.
Microarrays
(Análisis de expresión de genes)
El estudio de los niveles de expresión de todos los genes de un organismo se materializa con los experimentos de microarrays de ADNc. Aunque existen diversas variantes, las distintas tecnologías existentes se basan en un principio común: disponer una serie de sondas para los genes que queremos estudiar en un soporte sólido de manera ordenada. De esta manera sabremos que en una posición determinada de nuestro soporte encontramos una sonda para un gen determinado. Hay dos grupos principales de tecnologías, los microarrays fabricados con sondas depositadas por un robot y los de sondas sintetizadas in situ.
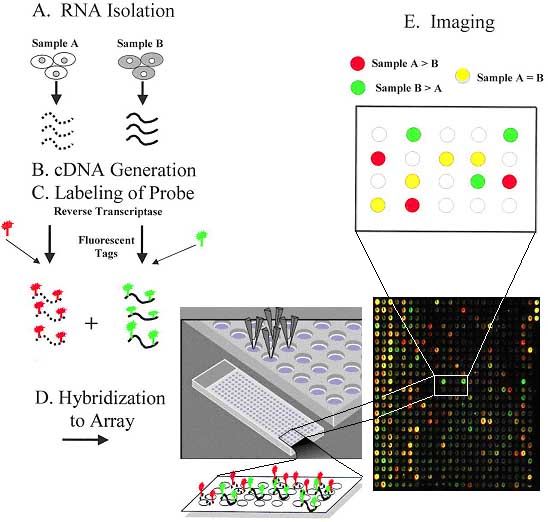
En el primer caso, las sondas están clonadas en un plásmido y son amplificadas por PCR almacenándose en formato de placa multipocillo. Estos productos, en presencia de un agente desnaturalizante como el dimetil-sulfóxido (DMSO), son depositados por un sistema robótico en un porta de microscopio tratado previamente con poli-lisina, tras lo cual se someten a un proceso de fijación del ADN mediante calor o radiación ultravioleta. Una vez preparados los cristales se puede proceder a la hibridación de los mismos: El ARN extraído de tejidos o células se marca con una molécula fluorescente en una reacción de retrotranscripción. Se hibridan dos muestras distintas con cada cristal, una muestra de referencia y una muestra problema cada una marcada con un fluorocromo diferente. Cada uno de los puntos del soporte representa a un gen determinado y la medida de la intensidad de fluorescencia emitida por dicho punto es proporcional al nivel de expresión del gen en el tejido de partida. Tras la hibridación se realiza un escáner de fluorescencia del microarray obteniéndose una imagen de la superficie del mismo.
Mediante un programa de análisis de imagen se pueden obtener los valores numéricos asociados a cada uno de los puntos. De cada hibridación, obtenemos finalmente una medida de la expresión relativa de cada uno de los genes del microarray en la muestra de referencia y problema. Una variante a este sistema serían los microarrays depositados en membranas de nylon y que son hibridados con una sola muestra marcada con radioactividad.
Una vez obtenidas las imágenes con un escáner de fósforo pueden ser analizadas de la misma forma que el sistema anterior. Para la comparación de diferentes muestras sin embargo, hay que tener las mismas consideraciones que con los microarrays de sondas sintetizadas in situ.
 |
En el caso de las sondas sintetizadas in situ, éstas son construidas en el propio soporte sólido mediante técnicas fotolitográficas semejantes a las empleadas para fabricar microchips de ordenadores. Las sondas se diseñan a partir de las secuencias para cada gen seleccionándose una serie de sondas de 25 nucleótidos, de manera que no se encuentre en otros genes más de un número de veces determinado . Total se escogen 16 sondas por cada gen. Además se emplea por cada sonda otra similar pero con una mutación en la base central. Esta sonda nos dará la hibridación inespecífica y del fondo.
Finalmente, para cada gen tenemos un conjunto de 32 sondas de 25 nucleótidos que permiten determinar la hibridación específica, la hibridación inespecífica y el fondo. Se hibrida una única muestra con cada chip por lo que hay que hibridar varios chips para realizar comparaciones. El ARN extraído de tejidos o células se convierte en ADNc mediante una retrotranscripción y luego se pasa a ARNc mediante una transcripción In Vitro, paso en el que es biotinilado. Posteriormente se fragmenta el ARNc mediante procedimientos químicos para permitir la hibridación con todas las sondas de cada gen existentes.
Tras la hibridación se somete a un proceso automático de lavado y marcado, seguido del escaneado. La imagen obtenida es analizada con el software MAS (Microarray Suite, Affymetrix) que permite obtener de cada chip un valor de expresión para cada uno de los genes representados en el chip. El sistema asigna una serie de identificadores que permiten determinar que genes están ausentes, presentes o marginales.
Un chip en el que se encuentran representados miles de genes, puede ser hibridado simultáneamente con dos sondas marcadas diferencialmente (por ejemplo con los fluorocromos Cy3, verde y Cy5, rojo) generadas a partir del mRNA de las muestras a comparar (por ejemplo, tejido normal versus tejido tumoral). Después de la hibridación, y utilizando un escáner, puede medirse en cada posición de DNA la intensidad de la fluorescencia para cada uno de los fluoróforos; en cada caso, el nivel de señal detectado en una posición determinada es proporcional al número de copias de mRNA de ese gen que hay en la muestra interrogada; el cociente de la intensidad de fluorescencia (Cy3/Cy5) es una medida de la expresión génica comparada relativa al gen representado en esa posición del chip.
Una vez se han realizado todas las hibridaciones que nuestro experimento requiera nos encontramos con una cantidad de datos enorme. Tenemos valores de expresión de miles de genes (~20.000 en el caso de los chips humanos) y esto se multiplica por el número de condiciones experimentales y de réplicas de cada condición que hayamos empleado.
Esto nos obliga en muchos casos a emplear técnicas de análisis estadístico y de data mining (técnicas de clustering, clasificación jerárquica, redes neuronales, etc.) que permitan extraer la información oculta en la enorme cantidad de datos de que disponemos.
