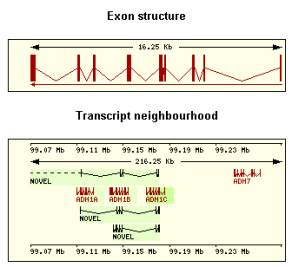
ADH1C
Transcript:(Llargada
total: 1459 bp No. Exons: 9)
Polimorfismes (SNP) Estructura exònica (ensembl)
Hines et al.(2001)
investigà l’efecte que té en l’infart de miocardi el consum moderat
d’alcohol i va veure que aquest varia segons el genotip d’adh3;
l’homozigositat per l’al·lel adh3*2 (gamma-2), que té una tassa més baixa d’oxidació
d’etanol, estava associat amb un risc reduït d’infart de miocardi. Malgrat
aquests resultats, el mecanisme d’aquesta associació no està clar.
![]() Hoog et al (1986)
estudià les diferències entre gamma-1 i gamma-2 i trobà dos aminoàcids
diferents:
Hoog et al (1986)
estudià les diferències entre gamma-1 i gamma-2 i trobà dos aminoàcids
diferents:
en
la posició 349: la isoleucina de gamma-1 és una valina a gamma-2. Sembla que aquesta diferència no té
especial importància ja que és un canvi conservatiu
d’un residu superficial.
![]() Efectivament,
es tracta d’un canvi sense conseqüències ja que ambdós residus són alifàtics i
ocupen un volum similar.
Efectivament,
es tracta d’un canvi sense conseqüències ja que ambdós residus són alifàtics i
ocupen un volum similar.
![]() en la posició 271:
l’arginina de la
gamma-1 és una glutamina
en la gamma-2. Aquest canvi explica diferències en les propietats de l’enzim:
la subunitat gamma-2 té menys movilitat catòdica quan s’evalua les dues
proteïnes en una electroforesi i, més important encara, com que aquest
aminoàcid es troba a la superfície de la butxaca d’unió al coenzim, el canvi
d’aminoàcid podria influenciar la dissociació del coenzim reduït.
en la posició 271:
l’arginina de la
gamma-1 és una glutamina
en la gamma-2. Aquest canvi explica diferències en les propietats de l’enzim:
la subunitat gamma-2 té menys movilitat catòdica quan s’evalua les dues
proteïnes en una electroforesi i, més important encara, com que aquest
aminoàcid es troba a la superfície de la butxaca d’unió al coenzim, el canvi
d’aminoàcid podria influenciar la dissociació del coenzim reduït.
![]() Novament,
la densitat elèctrica dels residus sembla ser la causa principal de la diferent
implicació funcional. La glutamina pot ser fàcilment ionitzable, però en tot
cas la seva ionització la deixaria carregada negativament (pèrdua del protó del
grup amino) i sembla que en aquesta posició la presència de càrrega positiva
(forta, com és el cas de l’arginina) és determinant.
Novament,
la densitat elèctrica dels residus sembla ser la causa principal de la diferent
implicació funcional. La glutamina pot ser fàcilment ionitzable, però en tot
cas la seva ionització la deixaria carregada negativament (pèrdua del protó del
grup amino) i sembla que en aquesta posició la presència de càrrega positiva
(forta, com és el cas de l’arginina) és determinant.