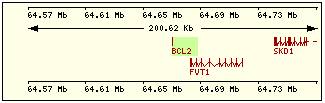
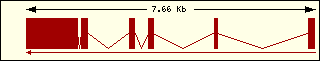
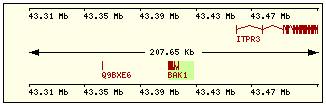
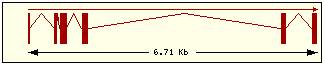
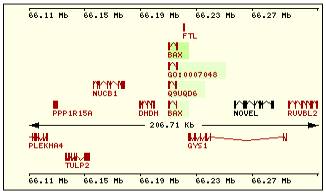
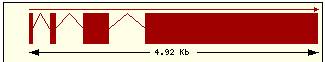
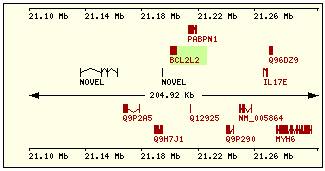
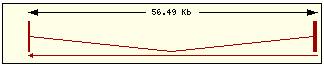
En aquesta
taula es mostra per cadascuna de les proteïnes de la família Bcl2 humana: la
localització cromosòmica del gen que la codifica, el número d’exons, la
llargada del trànscrit i la imatge de la seva estructura exònica.
|
Nom de la proteïna |
Cromosoma |
Número d’exons |
Llargada del cDNA(pb) |
Número de productes del gen |
Estructura exònica |
Esquema dels diferents trànscrits |
|
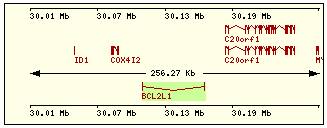
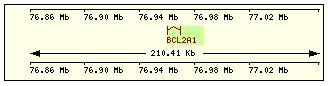
Bcl2 |
18q21.3 |
1 |
615 |
2 |
|
|
|
Bak |
6p21.3-.2 |
6 |
2098 |
2 |
|
|
|
Bax |
19q13.3-.4 |
6 |
576 |
4 |
|
|
|
Bcl w |
14q11.2-q12 |
4 |
3530 |
1 |
|
|
|
Bcl x |
20q11.2 |
2 |
924 |
2 |
|
|
|
Bfl-1 |
15q24.3 |
2 |
798 |
1 |
|
|
|
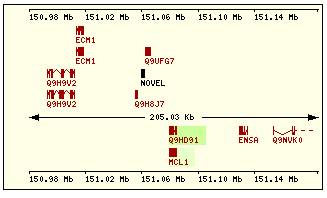
Mcl-1 |
1q21 |
3 |
3932 |
2 |
|
|
S1ha intentat trobar alguna relació o causalitat entre els dominis presents en cada proteïna i el número de dominis y la seva disposició en el seu gen respectiu però el resultatat ha sigut negatiu. Si pensem que cada domini està codificat per un exó estem equivocats, ja que Bcl2 conté 5 dominis diferents i en canvi un únic exó i en canvi l’estructura de Bclw: conté 4 exons i només 3 dominis, de manera que no podem arribar a cap conclusió per trobar una relació estructura-funció.
SNPs
Hem buscat en diferents bases de dades l’existència d’SNPs en les proteïnes
que formen la família Bcl2 humana:
![]() SNPdatabase (NCBI)
SNPdatabase (NCBI)
![]() HGMD (Human
Gen Mutation Database)
HGMD (Human
Gen Mutation Database)
![]() HGBASE (Human
Genic Bi-Allelic Sequences database of intra-genic DNA sequence polymorphisms)
HGBASE (Human
Genic Bi-Allelic Sequences database of intra-genic DNA sequence polymorphisms)
Encara que
existeixen una gran quantitat de SNPs en totes les proteïnes d’aquesta família,
només hem trobat que un d’ells sigui un polimorfisme que impliqui una fitness
biològica diferent respecte l’al·lel més freqüent. En els altres casos els
polimorfismes es troben en regions no-codificants (introns, 5’-3’UTRs) o en
regions codificants, on el canvi de codó és sinònim i no hi ha canvi
d’aminoàcid i, per tant, no té cap implicació biològica. En les poques ocasions
que hem trobat que el canvi és no sinònim, l’aminoàcid resultant és de
naturalesa molt semblant i no s’altera l’estructura terciària de la proteïna ni
la seva funcionalitat.
El polimorfisme de l’alanina 43 de Bcl2 a treonina
(GCCàACC, CM980213 a HGMD) comporta un
augment de la resistència a patir malalties autoimmunes (Komaki S. et al.). S’ha demostrat que els individus
amb malalties autoimmunes com: diabetis mellitus dependent d’insulina, artritis
reumatoide, lupus eritematòs i síndrome d’Sjogren tenen una freqüència de
treonina 43 significativament més baixa que en la població general.
![]()
![]()