Introducción
La apoptosis es un proceso
de muerte celular activo que se puede ver inducido tanto por factores de
transcripción como por toxinas y otros tipos de daño celular. Está controlado
por toda una serie de factores reguladores que pueden tener efecto inhibidor
(anti-apoptótico) o de bloqueo de este efecto protector (pro-apoptótico). Dentro de estos factores pro y
anti-apoptóticos destaca el papel de la familia de Bcl2. Todas las proteínas que pertenecen a ésta
contienen una combinación de los dominios BH1, BH2, BH3 y BH4 característica de
su función y un dominio transmembrana para anclarse a la membrana externa
mitocondrial de cara al citoplasma. Esta familia se puede dividir en dos
subfamilias:
![]() anti-apoptótica: promotores de la
supervivencia celular por inhibición de los adaptadores necesarios para la activación de
las caspasas. Todos los miembros contienen al menos los dominios BH1 y BH2 y
los miembros más parecidos a Bcl2 tienen los cuatro dominios. Forman parte
Bcl2, BclxL, Mcl1, Bclw y Bfl1 o A1.
anti-apoptótica: promotores de la
supervivencia celular por inhibición de los adaptadores necesarios para la activación de
las caspasas. Todos los miembros contienen al menos los dominios BH1 y BH2 y
los miembros más parecidos a Bcl2 tienen los cuatro dominios. Forman parte
Bcl2, BclxL, Mcl1, Bclw y Bfl1 o A1.

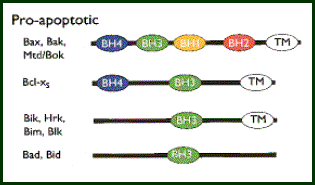
![]() pro-apoptótica: en esta subfamilia
hace falta distinguir dos grupos de proteínas: Bax y BH3. Los miembros del
primer grupo son Bax, Bak y Bok o Mtd y
contienen los tres primeros dominios homólogos a Bcl2. El segundo grupo no está
tan relacionado con Bcl2 exceptuando el tercer dominio (que es el único que
conservan) y solo Bik y Blk son parecidos entre si. Este grupo sélo se
encuentra en mamíferos.
pro-apoptótica: en esta subfamilia
hace falta distinguir dos grupos de proteínas: Bax y BH3. Los miembros del
primer grupo son Bax, Bak y Bok o Mtd y
contienen los tres primeros dominios homólogos a Bcl2. El segundo grupo no está
tan relacionado con Bcl2 exceptuando el tercer dominio (que es el único que
conservan) y solo Bik y Blk son parecidos entre si. Este grupo sélo se
encuentra en mamíferos.
Los miembros de las
familias anti y pro-apoptóticas pueden formar homo y heterodímeros y se piensa que
según su concentración actúan de una manera u otra sobre el programa
apoptótico. Se ha podido comprobar que los dominios BH1, BH2 y BH3 son los más
importantes en este tipo de interacción. Este fenómeno de dimerización es
importante para la actividad de la subfamilia pro-apoptótica. La célula en
estado basal forma homodímeros de Bcl2. Cuando se daña se empiezan a formar
heterodímeros Bcl2-Bax y cuando este daño es irreparable se forman los
homodímeros Bax que permitirán la salida al citoplasma del citocromo C y el
desencadenamiento de los procesos apoptóticos.
Estas proteínas se
encuentran en gran cantidad de organismos, o al menos hay homólogas de ellas
que tienen las mismas funciones. Incluso muchos virus han encontrado la manera
de contrarrestar la apoptosis defensiva de la célula huésped codificando sus
propias proteínas anti-apoptóticas.
Bcl2
Es una proteína de 25 KDa, que por splicing
alternativo da lugar a dos isoformas : a (que contiene la cola hidrofóbica para anclarse a la membrana y que parece
ser esencial para la función anti-apoptótica) y b. Su actividad viene regulada por mecanismos de
fosforilación/defosforilación por quinasas y fosfatasas activas, o no según la
fase del ciclo celular.
La función apoptótica
le viene de la capacidad de formación de complejos con las proteínas caspasa 9
y Apaf1 inhibiendo así la cascada de proteasas que da lugar a la apoptosis.
Esta función la lleva a cabo en una gran variedad de células donde además
regula la permeabilidad de la membrana mitocondrial evitando la liberación del
citocromo C.
Tiene capacidad de
formar homodímeros y heterodímeros con Bax, Bad, Bak y Bclx. La
heterodimeritzación con Bax requiere la interacción de los dominios BH1 y BH2
para la anti-apoptosis y BH4
es imprescindible para la actividad anti-apoptótica y la interacción con Raf1.
Bclx (vertebrados)
Tiene dos
isoformas generadas por splicing
alternativo llamadas BclxL, que es el producto más largo, y BclxS
que es el producto más corto. El primero es un potente inhibidor de la muerte
celular porque previene la liberación del citocromo C, que es el activador de la vía de las caspasas. Eso se lleva a
cabo mediante la heterodimeritzación con Bax, Bak y Bcl2. En cambio, BclxS
es un activador de la apoptosis.
Bax (mamíferos)
Bloquea la función anti-apoptótica de Bcl2
mediante la formación de heterodímeros. Existen cuatro isoformas: a, b, g y d también
generadas por splicing alternativo. No hay ninguna evidencia de que Bax
tenga ningún tipo de actividad en absencia de Bcl2.
Bfl1o A1 (mamíferos)
Específico de las células
hematopoyéticas y otros linajes medulares. Inhibe la apoptosis inducida por p53
o por la deprivación de IL-3 y mantiene la supervivencia endotelial durante
infecciones.
Bak (mamíferos)
En presencia de un estímulo apropiado, acelera la muerte celular programada uniéndose al represor Bcl2 y antagonizando su función.
Bclw (mamíferos)
Como miembro de la subfamilia antiapoptótica
promueve la supervivencia celular.
Mcl1 (humano)
Se encuentra involucrado en diferenciación y
mantenimento de la viabilidad pero no en proliferación.
![]()
![]()