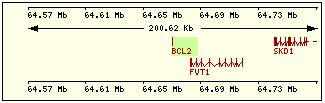
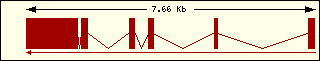
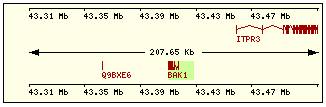
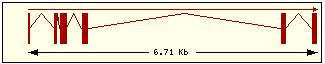
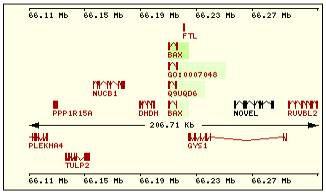
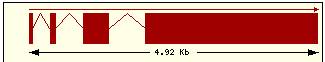
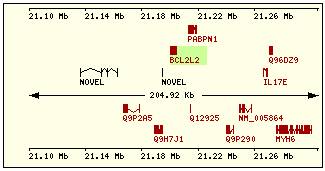
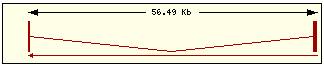
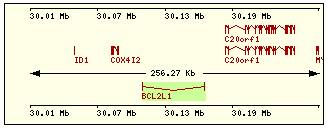
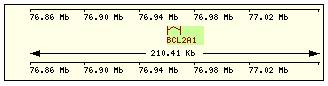
En esta tabla se muestra, para cada una de las proteínas de la familia Bcl2 humana: la localización cromosómica del gen que la codifica, el número de exones, la longitud del tránscrito y la imagen de su estructura exónica.
|
Nombre de la proteína |
Cromosoma |
Número de exones |
Longitud del cDNA(pb) |
Número de productos del gen |
Estructura exónica |
Esquema de los diferentes
tránscritos |
|
Bcl2 |
18q21.3 |
1 |
615 |
2 |
|
|
|
Bak |
6p21.3-.2 |
6 |
2098 |
2 |
|
|
|
Bax |
19q13.3-.4 |
6 |
576 |
4 |
|
|
|
Bcl w |
14q11.2-q12 |
4 |
3530 |
1 |
|
|
|
Bcl x |
20q11.2 |
2 |
924 |
2 |
|
|
|
Bfl-1 |
15q24.3 |
2 |
798 |
1 |
|
|
|
Mcl-1 |
1q21 |
3 |
3932 |
2 |
|
|
Se ha intentado encontrar alguna relación o causalidad entre los dominios presentes en cada proteína y el número de dominios y disposición en su gen respectivo pero el resultado ha sido negativo. Si pensamos que cada dominio está codificado por un exón estamos equivocados, ya que Bcl2 contiene 5 dominios diferentes y en cambio un único exón y en contraste la estructura de Bclw: contiene 4 exones y sólo 3 dominios, de manera que no podemos llegar a ninguna conclusión para encontrar una relación estructura-función.
SNPs
Hemos buscado en diferentes bases de datos la existencia de SNPs en las proteínas que forman la familia Bcl2 humana:
![]() SNPdatabase (NCBI)
SNPdatabase (NCBI)
![]() HGMD (Human
Gen Mutation Database)
HGMD (Human
Gen Mutation Database)
![]() HGBASE (Human
Genic Bi-Allelic Sequences database of intra-genic DNA sequence polymorphisms)
HGBASE (Human
Genic Bi-Allelic Sequences database of intra-genic DNA sequence polymorphisms)
Aunque existe una gran cantidad de SNPs en todas las proteínas de esta familia, solo hemos encontrado que un de ellos sea un polimorfismo que implique una fitness biológica diferente respecto al alelo más frecuente. En los otros casos los polimorfismos se encuentran en regiones no codificantes (intrones, 5’-3’UTRs), o en regiones codificantes, donde el cambio de codón es sinónimo, sin cambio de aminoácido y por tanto sin ninguna implicación biológica. En las pocas ocasiones en que hemos encontrado que el cambio no es sinónimo, el aminoácido resultante es de naturaleza muy semejante y no se altera la estructura terciaria de la proteína ni su funcionalidad.
El polimorfismo de la alanina 43 de Bcl2 a treonina (GCCàACC, CM980213 a HGMD) comporta un aumento de resistencia a sufrir enfermedades autoinmunes (Komaki S et al.). Ha sido demostrado que los individuos con enfermedades autoinmunes como: diabetes mellitus insulin-dependiente, artritis reumatoide, lupus eritematoso y síndrome de Sjogren tienen una frecuencia de treonina 43 significativamente más baja que en la población general.
![]()
![]()